微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用标准盐酸滴定未知浓度的氢氧化钠溶液,下列操作情况会使测得的氢氧化钠溶液浓度偏低的是
A.酸式滴定管用水润洗后,直接注入标准浓度的盐酸
B.滴定过程中,滴定管有少量漏液
C.滴定前读数准确,滴定完毕俯视读数
D.锥形瓶用水润洗后,再用待测的氢氧化钠润洗
参考答案:C
本题解析:A相当于稀释了盐酸,所以消耗盐酸的体积偏大,测定结果偏高。B中由于漏液,是的消耗的盐酸体积偏大,测定结果偏高。滴定管的读数自上而下逐渐递增,所以俯视读数,读数偏小,则盐酸的体积偏小,测定结果偏低。锥形瓶用水润洗后,再用待测的氢氧化钠润洗,则消耗盐酸的体积就偏大,,测定结果偏高。所以答案选C。
本题难度:简单
2、选择题 下列实验方案不合理的是
A.配制一定物质的量浓度的NaOH溶液时,将称好的NaOH固体放入50 mL的小烧杯中加水溶解,立即转移到100 mL的容量瓶中
B.往FeCl2溶液中滴入KSCN溶液,检验FeCl2是否已氧化变质
C.苯、液溴、铁粉混合制取溴苯
D.用焰色反应鉴别NaCl、KCl、BaCl2三种无色晶体
参考答案:A
本题解析:略
本题难度:简单
3、选择题 下列哪种试剂可将NaCl、Na2CO3、(NH4)2SO4、NH4Cl四种溶液区分开(? )?
A.AgNO3溶液
B.BaCl2溶液?
C.Ba(OH)2溶液
D.KOH溶液
参考答案:C
本题解析:四种都与硝酸银反应产生白色沉淀,A不正确。碳酸钠和硫酸铵都与氯化钡反应产生白色沉淀,B不正确。氯化钠和碳酸钠与氢氧化钠都不反应,D不正确。氯化钠和氢氧化钡不反应,碳酸钠和氢氧化钡反应产生白色沉淀,硫酸铵和氢氧化钡反应产生白色沉淀和氨气,氯化铵和氢氧化钡反应产生氨气,所以答案选C。
本题难度:一般
4、选择题 下列根据实验操作和现象所得出的结论正确的是(?)
选项
| 实验操作
| 实验现象
| 结 论
|
A
| 将少量Fe(NO3)2试样加水溶解,滴加稀H2SO4酸化,再滴加KSCN溶液
| 溶液变成红色
| Fe(NO3)2试样已变质
|
B
| 将少量某无色气体通入澄清石灰水
| 出现白色沉淀
| 该气体一定是CO2
|
C
| 分别测定常温下0.1 mol·L-1 Na2SiO3溶液和Na2CO3溶液的pH
| pH:
Na2SiO3
>Na2CO3
| 非金属性:
Si>C
|
D
| 向浓度均为0.1 mol·L-1 NaCl和NaI混合溶液中,滴加少量AgNO3溶液
| 出现黄色沉淀
| Ksp(AgCl)
>Ksp(AgI)
|
?
参考答案:D
本题解析:Fe(NO3)2溶液中,滴加稀H2SO4酸化后,相当于存在HNO3,会把Fe2+氧化为Fe3+,滴加KSCN溶液后变红色,不能确定Fe(NO3)2试样已变质,A错;SO2气体通入澄清石灰水,也会生成白色的CaSO3沉淀,B错;根据越弱越水解的规则,pH:Na2SiO3>Na2CO3,则非金属性:C >Si,C错;NaCl和NaI混合溶液中两者浓度相同,化合物类型相同,滴加AgNO3溶液时Ksp小的先生成沉淀,这里出现了AgI沉淀,所以Ksp(AgCl)>Ksp(AgI),D正确。
本题难度:一般
5、实验题 某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
甲同学认为两者反应只生成CuCO3一种沉淀;
乙同学认为这两者相互促进水解反应,生成一种Cu(OH)2沉淀;
丙同学认为生成CuCO3和Cu(OH)2两种沉淀。
(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
Ⅰ.按照乙同学的理解Na2CO3溶液和CuSO4溶液反应的离子反应方程式为:? _?;
在探究沉淀物成分前,须将沉淀从溶液中分离并净化。具体操作为 ①过滤②洗涤③干燥。
Ⅱ.请用下图所示装置,选择必要的试剂,定性探究生成物的成分。
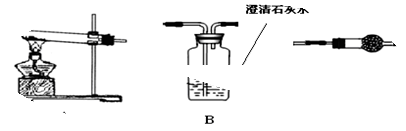
(1)各装置连接顺序为? ??
?? ?。
?。
(2)装置C中装有的试剂名称是?。
(3)按你的装置连接顺序,甲的猜想是正确的,则可通过________________________现象来说明甲的猜想是正确的。
Ⅲ.若CuCO3和Cu(OH)2两者都有,丙同学通过装置Ⅰ进行定量分析来测定其组成。
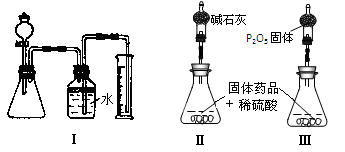
(1)实验有关操作为:①往锥形瓶中放入适量的样品:②从分液漏斗往锥形瓶中加入过量的稀硫酸;③检验装置的气密性;④测定收集到水的体积。
正确的操作顺序为____________________。
(2)广口瓶中水的上面覆盖了一层植物油,若瓶中的液体没有装满(上方留有少量空间),实验测得CO2的体积将___________(填偏大、偏小或不变)。
(3)若实验中测得样品的质量为wg,气体的体积为aL(标况下),则样品中CuCO3的质量分数为___________(CuCO3的式量为124)。
(4)丁同学认为,丙同学的实验方法,可能因气体体积测量不准,导致误差较大。建议改用图中的Ⅱ、III装置进行实验。只需进行简单而又必要的数据测定,可比较准确地确定样品中CuCO3的质量分数,较合理的装置_______(填代号)。但是丁同学的装置仍然有缺陷,所测结果将偏高或偏低__________。理由是___________________________
参考答案:Ⅰ.Cu2++CO32-+H2O=Cu(OH)2+CO2
Ⅱ.ACB?无水硫酸铜? C中固体不变蓝,B中出现浑浊
Ⅲ. 3124?不变? a/22.4×124/W?Ⅲ
偏高 锥形瓶中水蒸气残留?或者偏低?吸收空气中的水蒸气
本题解析:
Ⅰ乙同学的认为:这两者相互促进水解反应,生成Cu(OH)2一种沉淀,即是碳酸钠和硫酸铜之间发生双水解反应,原理为:Na2CO3+CuSO4+H2O═Cu(OH)2↓+Na2SO4+CO2↑
Ⅱ.(1)利用加热装置验证生成的产物,利用A加热分解碳酸铜或氢氧化铜,利用C检验是否有水生成验证是否含有氢氧化铜;利用装置B中 石灰水变浑浊证明生成二氧化碳验证碳酸铜的存在,所以装置连接为A、C、B;
(2)无水硫酸铜可以检验水的产生和存在,放在干燥管中来检验,故答案为:无水硫酸铜;
(3)碳酸铜受热分解会产生氧化铜和二氧化碳,二氧化碳可以使澄清的石灰水变浑浊,
Ⅲ(1)应先进行装置气密性检验,然后依次加入固体药品、液体药品,最后进行气体排出水的测量,确定产生气体体积;
(2)广口瓶的液体没有装满,不会影响测定的结果
(3)产生的气体二氧化碳气体的体积为aL,n CO2="n" CuCO3=" a/22.4,m" CuCO3= a/22.4×124
则样品中CuCO3的质量分数为a/22.4×124/W
(4)较合理的装置是Ⅲ,因为用碱石灰吸收二氧化碳和水,无法求出CuCO3的质量。P2O5只吸收水蒸气。先求Cu(OH)2,再求得CuCO3的质量。
此题的答案是开放性的,只要合理就行;偏高 锥形瓶中水蒸气残留?或者偏低?盛有P2O5的干燥管吸收空气中的水蒸气,质量偏大,导致Cu(OH)2质量偏大,测得的CuCO3的质量分数偏低。
本题难度:一般