微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 X、Y、Z、W、T是元素周期表中前四周期的五种元素。有关这五种元素的信息如下表:
元素代号
| 相关信息
|
X
| 它的一种核素的原子核内没有中子
|
Y
| 能组成很多种性质不同的单质,也是形成化合物种类最多的一种元素
|
Z
| 基态原子的最外层电子排布式为nsnnpn+1
|
W
| 与钾元素能组成多种化合物,这些化合物与水反应均生成碱;大气平流层中W3被誉为地球生物“保护伞”
|
T
| 主要化合价有+1和+2价,且[T(X2W)4]2+和[T(ZX3)4]2+均呈蓝色
|
?
请推出具体元素,用具体元素回答下列问题:
(1)根据元素周期律可以设计出多种形式的周期表,下列是扇形元素周期表:

T元素在扇形元素周期表中的位置是?(填表中带圆圈的数字);上表中⑨号位置?的元素基态原子未成对电子数为?;2012年6月2 5日,俄罗斯杜布纳核联合研究所再次成功合成117号元素,它将被列入元素周期表,“117”元素在扇形元素周期表中的位置是?(填表中带圆圈的数字)。
(2)质量数为2的X基态原子的电子排布式为?,在这五种元素中电负性最大的是?。
(3)由上述五种元素中的某些元素形成的离子,该离子中每个原子最外层均有8个电子且?与Z3-具有相同质子数和电子数,则这种离子的结构式为?。
(4)TW在高温条件下是一种优良的氧化剂,它能将很多有机化合物完全氧化(相当于完全燃烧),写出高温条件下,TW与Y最简单的氢化物反应的化学方程式:?。
(5)已知在25℃、101 kPa下:
XYZ(aq)+X2W(1)  YZ- (aq)+X3W+(aq)? ΔH="+45.6" KJ/mol
YZ- (aq)+X3W+(aq)? ΔH="+45.6" KJ/mol
X3W+(aq)+WX(aq)=2X2W(1)?ΔH="-57.3" KJ/mol
则在25℃、101 kPa的稀溶液中,XYZ与WX反应的热化学方程式(以离子厅程式表示):?。
参考答案:(共14分)
(1)③? 4(各2分,共4分)?⑨(1分)
(2)? ls1?O(各1分,共2分)
(3)O=C=N-或-O—C三N (2分)
(4)CH4+4CuO4Cu+CO2+2H2O(2分)[条件不写扣1分,配平错误或化学式写错0分]
(5)HCN(aq)+OH-(aq)=CN-(aq)+H2O(1)?ΔH="-11.7" kJ/mol(3分)[化学式错0分,状态标错扣? 1分,ΔH错扣2分]
本题解析:根据题意可以推断出X、Y、Z、W、T分别为H、C、N、O、Cu,结合元素周期表和周期律的相关知识可以解决。
本题难度:一般
2、选择题 某元素的原子核外有3个电子层,最外层有7个电子,其核内的质子数为
A.14
B.15
C.16
D.17
参考答案:D
本题解析:考查原子核外电子的排布规律。由于K、L层分别容纳的电子是2和8,所以质子数等于17,答案选D。
本题难度:简单
3、填空题 (8分)A+、B―、C、D四种微粒中均有氢原子,且电子总数均为10个。溶液中的A+和B―在加热时相互反应可转化为C和D。则A+是 ,B―是 ,C是______,D是______。
参考答案:A+是 NH4+,B―是 OH-? ,C是_NH3___ ,D是__H2O_____。
本题解析:电子总数为10个的粒子一般在氖原子附近寻找,然后跟氢元素搭配,把含10电子的元素都一一写出来,然后带入题目,结合溶液中的A+和B―在加热时相互反应可转化为C和D,此反应应为NH4+?+? OH-?=? NH3?+? H2O,不难得出上述答案。
本题难度:一般
4、选择题 下列各组物质中都属于纯净物的一组是
A.液态氧? 汽水
B.洁净的空气? 纯净的盐酸
C.冰水混合物? 干冰
D.铁矿石? 金刚石
参考答案:C
本题解析:汽水、空气、盐酸、铁矿石都属于混合物.
本题难度:一般
5、填空题 (14分)A、B、C、D、E、F均为短周期元素,原子序数依次递增。A元素原子核内无中子。B元素原子最外层电子数是次外层电子数的2倍。C元素是地壳是含量最多的元素。D是短周期元素中金属性最强的元素。E与F的位置相邻,F的最高价氧化物的水化物为最强的酸。
(1)推断B在元素周期表中的位置:?。
(2)写出A与C形成的10电子的阳离子化学式:?。(用对应的化学符号填空,下同)
(3)E、F两种元素中非金属性较强的是?;用电子式表示D2C形成过程?
(4)D、E形成的正盐的水溶液中,阴离子的浓度大小顺序为:?(从大到小排列)。
(5)常温下,1molA元素的单质与C元素的单质化合,放出286kJ的热量,写出反应的热化学方程式:?
(6)甲是A和C按原子个数比1:1组成的化合物。已知甲的溶液能使酸性高锰酸钾溶液褪色。将含有0.5mol甲的溶液滴加到100mL? 2mol/L酸性高锰酸钾溶液中,溶液紫色恰好褪去,该反应的离子方程式为 ?
参考答案:(1) 第二周期?第IVA族?(2)H3O+
(3)Cl?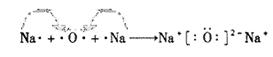 ?
?
(4)C(S2-)>C(OH-)>C(HS-)
(5)H2(g) + 1/2O2(g) ="==" H2O(l)?△H=-286KJ·mol-1 (其他合理答案也对)
(6) 2MnO4-+5H2O2+6H+ = 2Mn2+ +5O2↑+8H2O
本题解析:“A元素原子核内无中子”,则A为11H;B元素的核外电子排布为2 4,则B为碳元素;“C是地壳中含量最多的元素”,则C为氧元素、;“D是短周期中金属性最强的元素”,则D为钠元素;“F与E位置相邻,F的最高价氧化物的水化物为最强的酸。,则F为氯元素、E为硫元素;(1)根据电子层数=周期序数,最外层电子数=主族序数,B在元素周期表中的位置第二周期?第IVA族?;(2)A与C形成的10电子的阳离子化学式:H3O+;(3)E、F两种元素中非金属性较强的是Cl;用电子式表示D2C形成过程 。(4)D、E形成的正盐是硫化钠,其水溶液呈碱性,阴离子的浓度大小顺序为:C(S2-)>C(OH-)>C(HS-)。(5)反应的热化学方程式:H2(g) + 1/2O2(g) ="==" H2O(l)?△H=-286KJ·mol-1;(6)甲是A和C按原子个数比1:1组成的,则甲为过氧化氢。已知甲的溶液能使酸性高锰酸钾溶液褪色,说明被高锰酸钾氧化了,0.5mol甲与0.2mol酸性高锰酸钾溶液恰好反应,即比值为5:2,据此信息则该反应的离子方程式为 2MnO4-+5H2O2+6H+ = 2Mn2+ +5O2↑+8H2O。
。(4)D、E形成的正盐是硫化钠,其水溶液呈碱性,阴离子的浓度大小顺序为:C(S2-)>C(OH-)>C(HS-)。(5)反应的热化学方程式:H2(g) + 1/2O2(g) ="==" H2O(l)?△H=-286KJ·mol-1;(6)甲是A和C按原子个数比1:1组成的,则甲为过氧化氢。已知甲的溶液能使酸性高锰酸钾溶液褪色,说明被高锰酸钾氧化了,0.5mol甲与0.2mol酸性高锰酸钾溶液恰好反应,即比值为5:2,据此信息则该反应的离子方程式为 2MnO4-+5H2O2+6H+ = 2Mn2+ +5O2↑+8H2O。
本题难度:一般