微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)将复杂硅酸盐改写成氧化物形式:KAlSi3O8:?。
(2)有一包白色粉末可能由K2SO4、NaHCO3、BaCl2、FeCl3、KCl五种物质中的某几种组成,现进行如下实验:
①将白色粉末加水溶解,得无色溶液。
②向①中所得的无色溶液中加入NaOH溶液,观察到有白色沉淀A生成,过滤后,向滤液中滴加硝酸酸化的AgNO3溶液,又得到白色沉淀B。
根据上述现象判断:
①A的化学式是??B的化学式是?。
②原白色粉末中一定含有?,可能含有?,
对可能含有的物质,可通过?(填实验名称)进一步检验。检验操作步骤有:①蘸取待测液;②置于酒精灯火焰上灼烧;③透过蓝色钴玻璃观察;④用稀盐酸洗净铂丝。其中正确的操作顺序为?。
A.①②③④? B.④①②③? C.④②①②③④? D.①③②④
参考答案:
(1)K2O·Al2O3·6SiO2
(2)①BaCO3? AgCl?②NaHCO3、BaCl2? KCl?焰色? C
本题解析:(1)硅酸盐由盐的书写改写为氧化物的形式即改写的一般方法归纳为:碱性氧化物、两性氧化物、酸性氧化物、水(xMO?nSiO2?mH2O),所以KAlSi3O8可表示为:K2O?Al2O3?6SiO2,(2)①FeCl3溶液为棕黄色,将白色粉末加水溶解,得无色溶液,所以一定不含有FeCl3,K2SO4和BaCl2会发生沉淀反应K2SO4+BaCl2 =BaSO4↓+2KCl.而不能大量共存。所以二者至多有一种。向①中所得的无色溶液中加入NaOH溶液并加热,仅观察到有白色沉淀A生成,则一定含有碳酸氢钠和氯化钡,就不含有K2SO4。NaHCO3+NaOH= Na2CO3+ H2O,Na2CO3+ BaCl2=BaCO3↓+2NaCl。过滤后,向滤液中滴加硝酸酸化的AgNO3溶液,又得到白色沉淀B,则该白色沉淀为氯化银。 有白色沉淀A生成,则还是证明溶液中含有碳酸氢钠和氯化钡。氯离子可能是氯化钡电离产生,也可能是KCl电离产生。因此不能确定是否含有KCl。钾离子的检验,可通过焰色反应检验,焰色反应的操作步骤:④用稀盐酸洗净铂丝,②置酒精灯火焰上灼烧,①蘸取待测液,②置于酒精灯火焰上灼烧,③透过蓝色钴玻璃观察火焰颜色,④用稀盐酸洗净铂丝,故正确选项为C。
本题难度:一般
2、实验题 人造金刚石酸洗废液中含有大量的Ni2+、Mn2+、Co2+离子,不经处理排放危害极大。某工厂技术人员设计了创新方案,使有害离子的浓度降低到排放标准,同时得到了纯度较高的镍粉。
废液经分析组成如下:

在强酸性的废液中加入NaOH调节pH到2,在搅拌下加入饱和Na2CO3溶液和NaClO除去Mn2+、Co2+,并控制pH不超过3.5(Na2CO3需缓慢加入,防止产生大量CO2而冒槽),过滤后电解含Ni2+的过滤液,以镍铬钛不锈钢片为阴极,以铅片为阳极,电解后在阴极得到镍粉。回答下列问题
⑴ 调节强酸性废液至pH=2,可否直接用饱和Na2CO3溶液?分析你的原因
⑵ 写出除去废液中Mn2+、Co2+的反应方程式
⑶ 搅拌过程中Ni不被沉淀下来,实际操作中是如何实现?
⑷ 电解过程中电流效率与pH的关系如下图,试分析如下图所示变化的原因.并选择电解的最佳pH值
参考答案:⑴ 不可以,将产生大量CO2而冒槽?(1分)
⑵ 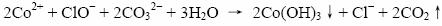
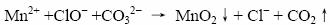 ?(2分)
?(2分)
⑶ 根据废液离子浓度分析结果,控制NaClO用量,可使Mn2+,Co2+沉淀完而Ni2+不被沉淀。(1分)
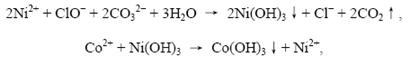
⑷ pH较低时,将产生大量氢气,电流效率低;pH>4.5时,将产生Ni(OH)2沉淀,Ni2+浓度下降,不利于Ni的析出。(2分)选择在4.0-4.5左右?(1分)
本题解析:⑴认真阅读试题可从题中获得相关信息,当溶液酸性太强时,直接加入饱和Na2CO3溶液会产生大量的CO2,从而发生冒槽。
⑵Mn2+、Co2+在碱性增强的条件下,被ClO-氧化并生成沉淀,通过过滤的方法可以除去这两种杂质离子——这是溶液中除杂最常用的方法之一,如Fe2+的除杂。
Mn2+在碱性条件下,被氧化为+4,以MnO2的形式被除去,离子方程式为:
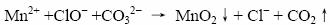
Co2+在碱性条件下不稳定,生成Co(Ⅲ)的氢氧化物,离子方程式如下:
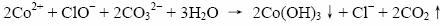
在书写离子方程式的时候,也应该结合题意,溶液由于pH<3.5,仍为酸性条件,所以CO32-结合H+,生成CO2气体。
⑶Ni(Ⅲ)和Co(Ⅲ)都有很强的氧化性,但Ni(Ⅲ)非常不稳定,氧化性比Co(Ⅲ)化合物的氧化性强,因此只要ClO-适量,即使Ni2+被氧化生成了三价镍的化合物,也会被未参加反应的Co2+、Mn2+还原为Ni2+。因此防止Ni2+被沉淀的方法就是控制ClO-的用量。
⑷从图中曲线变化趋势可以看出,当溶液酸性较大时,电解效率很低,随着pH的增大,电解效率增大,但是当pH>4.5后,电解率与溶液pH变化不明显。因此此处要重点分析pH较小时电解效率不高,以及pH较大时电解效率也不高的原因。
由于H+、Ni2+都能在电极的阴极放电,所以当pH较小,也即[H+]较大时,将产生大量的氢气,造成电解效率较低。当pH较大时,由于Ni2+生成了难溶物,溶液中[Ni2+]减小,也造成电解效率低。因此,从图中可以看出来,最佳的pH范围大约为4.0~4.5。
本题难度:一般
3、实验题 (6分)在除杂质的实验操作中,为了将溶液中的杂质完全去除,通常需加入过量的除杂质试剂。某校化学课外活动小组为了除去粗盐中含有少量Na2SO4、MgCl2,设计了下列实验步骤:
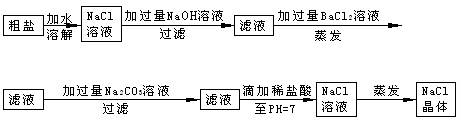
试简要说明(1)加入过量BaCl2的溶液的原因_______??。
(2)加入过量Na2CO3的溶液的原因______?___?_?_。
(3)滴加稀盐酸直至pH=7的目的是____?___?__。
参考答案:(1)使SO42-完全沉淀而除去?(2)使Ba2+完全沉淀而除去?(3)除去过量的OH-、CO32-,得到NaCl溶液
本题解析:略
本题难度:一般
4、选择题 下列物质的除杂方法中,合理的是
①CO2中混有的SO2杂质可以让混合气体通过饱和小苏打溶液除去
②乙烯中混有的SO2气体可以通过KMnO4溶液除去
③K2CO3中混有的少量NaHCO3,可以用加热的方法除去
④KNO3中含有的少量NaCl可以通过重结晶的方法除去
⑤水中的SO42-、Na+、K+、Cl-等可以通过电渗析法除去( )
A.②④
B.①④⑤
C.①④
D.①②③④⑤
参考答案:①饱和小苏打溶液可以与SO2气体反应生成二氧化碳和亚硫酸钠,故①正确;
②乙烯能被高锰酸钾氧化为二氧化碳,将原物质除掉,故②错误;
③碳酸氢钠受热分解生成碳酸钠,仍有钠离子杂质,故③错误;
④NaCl的溶解度受温度影响不大,但硝酸钾的溶解度受温度影响较大,则可利用结晶、重结晶来除去KNO3中的NaCl杂质,故④正确;
⑤电渗析法是一种利用离子交换膜进行离子交换的方法,可用电渗析法除去水中的SO42-、Na+、K+、Cl-等,故⑤正确;
故选B.
本题解析:
本题难度:简单
5、选择题 硫酸亚铁溶液中若含有少量的硫酸铜和硫酸铁,为除去这两种杂质,提纯硫酸亚铁,可向溶液中加人的物质是( )
A.锌粉
B.镁粉
C.铁粉
D.铝粉
参考答案:在溶液中加入铁粉,分别发生:Fe+CuSO4=FeSO4+Cu、Fe+Fe2(SO4)3=3FeSO4,可除去杂质,而加入锌粉、镁粉以及铝粉引入新杂质.
故选C.
本题解析:
本题难度:简单