微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 某课外活动小组设计了以下实验方案验证Ag与浓HNO3反应的过程中可能产生NO.其实验流程图如下:

(1)测定硝酸的物质的量反应结束后,从如图B装置中所得100mL溶液中取出25.00mL溶液,用0.1mol?L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如图所示.
在B容器中生成硝酸的物质的量为______,则Ag与浓硝酸反应过程中生成的NO2的物质的量为______.

(2)测定NO的体积
①从图所示的装置中,你认为应选用______装置进行Ag与浓硝酸反应实验,选用的理由是______.
②选用图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是______(填各导管口编号).
③在读取量筒内液体体积之前,应进行的操作______.
(3)气体成分分析
若实验测得NO的体积为112.0mL(已折算到标准状况),则Ag与浓硝酸反应的过程中______(填“有”或“没有”)NO产生,作此判断的依据是______.
参考答案:(1)B容器中是二氧化氮和水反应生成硝酸和一氧化氮;100mL溶液中取出25.00mL溶液,用0.1mol?L-1的NaOH溶液滴定,用酚酞作指示剂,终点时,消耗氢氧化钠溶液的题为20.4ml-0.4ml=20ml;所以生成硝酸25.00mL溶液中含有0.02L×0.1mol/L=0.002mol;则B容器中生成硝酸的物质的量为0.008mol;由3NO2+H2O=2HNO3+NO可知金属与硝酸反应生成二氧化氮物质的量为0.012mol,
故答案为:0.008?mol;0.012?mol;
(2)①一氧化氮气体易被氧气氧化生成二氧化氮对验证产生干扰,AD相比A装置利用氮气可以把装置中 的空气排净;
故答案为:A;因为A装置可以通入N2将装置中的空气排尽,防止NO被空气中O2氧化;
②用A进行银和浓硝酸的反应,用水吸收生成的二氧化氮气体,导气管长进短出,可以用排水量气法测定一氧化氮气体的体积,排水集气瓶导气管应短进长出,连接顺序为:123547,
故答案为:123547;
③读数之前应保持内外压强相同,恢复到室温下读取量筒中 液体的体积,故答案为:等液体冷却到室温,并使集气瓶和量筒内液面相平;
(3)实验测得NO的体积为112.0mL(已折算到标准状况),依据上述计算得到银和浓硝酸生成二氧化氮气体物质的量为0.012mol,依据3NO2+H2O=2HNO3+NO;计算得到一氧化氮气体物质的量为0.004mol,标准状况下体积为0.004×22.4L/mol=0.0896L=89.6ml<112.0L可知银和硝酸反应生成一氧化氮气体,
故答案为:有;因为NO2与水反应生成的NO的体积小于收集到的NO的体积(89.6<112.0).
本题解析:
本题难度:一般
2、实验题 (14分)醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷的装置如下图所示,试管d中装有少量蒸馏水.已知溴乙烷的沸点为38.4oC,密度为1.43g·ml-1;
可能存在的副反应有:加热反应过程中反应混合物会呈现黄色甚至红棕色;醇在浓硫酸的存在下脱水生成烯和醚等。
(1)制备溴乙烷的需要用到蒸馏水、乙醇、溴化钠、浓硫酸,在烧瓶中加入这几种物质的顺序是?。
(2)小火加热,在烧瓶中发生的主要反应有①NaBr + H2SO4?= NaHSO4 + HBr
②?.;
(3)冷水的作用??;d试管中的现象?,
(4)用这种方法制取的溴乙烷中的含少量杂质Br2,欲除去溴代烷中的少量杂质Br2,下列供选试剂中最适合的是__________。
A.NaI溶液? B.NaOH溶液? C.Na2SO3溶液? D.KCl溶液?
(5)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞.请写出发生堵塞时瓶b中的现象________________
(6)容器e中NaOH溶液的作用是__________________________________.
(7)制备操作中,加入的浓硫酸必需进行适当的稀释,其目的是_______。
A.减少副产物烯和醚的生成? B.减少Br2的生成
C.减少HBr的挥发?D.水是反应的催化剂?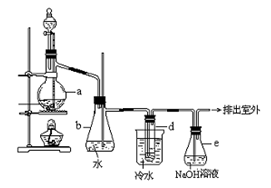
参考答案:每小题2分
(1)蒸馏水、浓硫酸、乙醇、溴化钠
(2)CH3CH2OH + HBr = CH3CH2Br +H2O
(3)冷却溴乙烷由气态转变为液态;分层,下层为油状液体(意思对即可得分)
(4)C
(5)直导管中有一段水柱(意思对即可得分)
(6)吸收HBr等气体,防止大气污染(意思对即可得分)
(7)ABC? (漏选1分,错选不得分)
本题解析:略
本题难度:简单
3、填空题 糖类、蛋白质是基本的营养物质,在我们的生活中扮演着及其重要的角色.如何识别这些物质的真伪,既可以检验同学们将化学知识与实际相结合的能力水平,又可以减少伪劣物品对我们生活质量的负面影响.请根据下列的实验现象填写下表:
①烧焦羽毛味;②蓝色;③银镜(析出银);④砖红色沉淀;⑤黄色
| 被鉴别的物质 | 鉴别物质(或鉴别方法) | 现象(填入序号即可)
葡萄糖
新制氢氧化铜
______
淀粉
碘水
______
蛋白质
浓硝酸
______
蛋白质
燃烧
______
葡萄糖
银氨溶液
______
参考答案:葡萄糖是多羟基醛,和新制氢氧化铜反应生成砖红色沉淀,故选④;
淀粉遇碘单质变蓝是碘单质的特性,故选②;
蛋白质与浓硝酸变黄,故选⑤
蛋白质燃烧有烧焦羽毛味,故选①;
葡萄糖和银氨溶液加热反应析出银,发生银镜现象,故选③,
故答案为:④;②;⑤;①;③.
本题解析:
本题难度:一般
4、简答题 亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如图所示(部分夹持装置略).(在木炭和浓硝酸反应之前已排尽装置中的空气)
已知:室温下,①2NO+Na2O2═2NaNO2②3NaNO2+3HCl═3NaCl+HNO3+2NO↑+H2O;
③酸性条件下,NO或NO2-都能与MnO3-反应生成NO3-和Mn2+
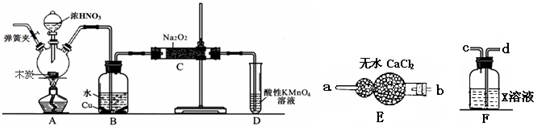
(1)写出浓硝酸与木炭反应的化学方程式______.
(2)B中观察到的主要现象是______,D装置的作用是______.
(3)检验C中产物有亚硝酸钠的方法是______.
(3)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和______.为避免产生这些副产物,应在B、C装置间增加装置E、F,则B中导管与E、F装置中导管接口的连接顺序是______.
参考答案:(u)装置A中是浓硝酸和碳加热发反应,反应生成二氧化氮和二氧化碳和水,反应的化学方程式为C+4HNO3(浓)&n2sp;&n2sp;△&n2sp;&n2sp;.&n2sp;CO2↑+4NO2↑+2H2O,
故答案为:C+4HNO3(浓)&n2sp;&n2sp;△&n2sp;&n2sp;.&n2sp;CO2↑+4NO2↑+2H2O;
(2)装置2中是A装置生成的二氧化氮和水反应生成硝酸和一氧化氮,3NO2+H2O=2HNO3+NO,硝酸和铜反应生成硝酸铜,一氧化氮和水,所以反应现象为溶液变蓝,铜片溶解,导管k有无色气体冒出;通过装置C中的过氧化钠吸收一氧化氮、二氧化碳,最后通过酸性高锰酸钾溶液除去剩余一氧化氮防止污染空气,
故答案为:铜片溶解,溶液变蓝,导管k有无色气体冒出;除去未反应的NO,防止污染空气;
(3)检验亚硝酸钠的实验设计为:取少量生成物置于试管中,加入稀盐酸,若产生无色气体并在液面上方变为红棕色,则产物是亚硝酸钠.
故答案为:取样,加入稀盐酸,若产生无色气体并在液面上方变为红棕色,则产物是亚硝酸钠;
(4)因为一氧化氮中混有二氧化碳和水蒸汽,二氧化碳和过氧化钠发生的反应生成碳酸钠和氧气,水与过氧化钠反应生成氢氧化钠,故C产物中除亚硝酸钠外还含有副产物碳酸钠和氢氧化钠,为避免产生这些副产物,应在2、C装置间增加装置E、F,依次除去二氧化碳和水蒸气,则2中导管与E、F装置中导管接k的连接顺序是dc2a.故答案为:氢氧化钠;dc2a.
本题解析:
本题难度:简单
5、实验题 (10分)化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用。
(1)下列关于实验的叙述正确的有______。
A.燃着的酒精灯不慎碰翻失火,应立即用湿布盖灭
B.测量溶液的pH时,应先将pH试纸润湿
C.配制硫酸溶液时,可先在量筒内加入一定体积的水,再在搅拌下慢慢加入浓硫酸
D.不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液
|
(2)要配制500 mL 0.2 mol·L-1的FeSO4溶液,实验操作步骤有:①在天平上称取a g绿矾(FeSO4·7H2O),将它放在烧杯中,用适量蒸馏水使其完全溶解;②将所得溶液沿玻璃棒注入500 mL容量瓶中;③继续向容量瓶中加水至液面距刻度线1 cm~2 cm处,改用胶头滴管加蒸馏水至液体凹液面最低处与刻度线相切;④用少量水洗涤烧杯和玻璃棒2次~3次,每次洗涤液都转入容量瓶;⑤将容量瓶塞紧,充分摇匀。填写下列空白:
①a g绿矾的实际质量为________ g。
②上述操作步骤的正确顺序为__________________。
③若配制时遗漏步骤④,会使所配溶液的浓度________(填“偏高”“偏低”或“无影响”)。
④若加蒸馏水时不慎超过刻度线,处理方法是________________;若操作步骤②时有溶液溅在容量瓶外,处理方法是________________。
参考答案:(1)AD
(2)①27.8
②①→②→④→③→⑤
③偏低
④重新配制 重新配制?
本题解析:(1)中B项测量溶液pH时,试纸不能润湿,否则可能产生误差;C项配制溶液不能在量筒中进行;
(2)①据公式n=cV,m=nM=cVM=0.2 mol·L-1×0.5 L×278 g·mol-1=27.8 g。②操作基本步骤:称量→溶解→(室温)转移→洗涤转移→定容→摇匀。③④考查操作过程中误差分析及如何处理不正确的操作。特别注意:加水过多和移液时溅到瓶外等过错无法补救,只能重配。
本题难度:一般