微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某化学兴趣小组为探究铜跟浓硫酸的反应,用下图所示装置进行有关实验
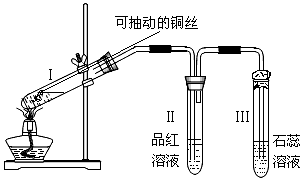
请回答下列问题:
(1)试管Ⅰ中发生反应的化学方程式为:___________________________。
(2)可抽动铜丝的作用是___________________________。
(3)试管Ⅱ中现象为____________,可证明____________;试管Ⅲ中现象为____________,
可证明____________。
(4)试管Ⅲ的管口用浸有碱(NaOH溶液)的棉团塞住其作用是____________; 发生的反应为________________________。
(5)①实验开始时时,取ag铜丝和VmL18mol/L浓硫酸放在试管中共热。反应进行一段时间后,铜丝还有剩余,且能深入溶液内,但发现继续加热,铜丝不再溶解。该小组同学根据所学化学知识认为还有一定的硫酸剩余,你认为原因是________________________。
②该小组同学通过实验测得剩余铜丝质量为bg(假设反应前后溶液的体积不变),则剩余硫酸的物质的量浓度为____________mol/L。
参考答案:(1)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(2)抽动铜丝,以随时中止反应
(3)品红溶液褪色;SO2具有漂白性;石蕊溶液显红色;SO2溶于水显酸性
(4)吸收SO2气体,防止空气污染;SO2+2NaOH==Na2SO3+H2O
(5)①反应过程中浓硫酸在被消耗的同时还有水生成,浓硫酸逐渐变稀,而铜不与稀硫酸反应
②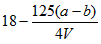
本题解析:
本题难度:一般
2、实验题 (12分)高纯 是制备高性能磁性材料的主要原料。实验室以
是制备高性能磁性材料的主要原料。实验室以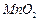 为原料制备少量高纯
为原料制备少量高纯 的操作步骤如下:
的操作步骤如下:
(1)制备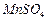 溶液:
溶液:
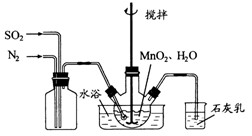
在烧瓶中(装置见上图)加入一定量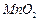 和水,搅拌,通入
和水,搅拌,通入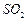 和
和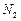 混合气体,反应3h。停止通入
混合气体,反应3h。停止通入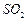 ,继续反应片刻,过滤(已知
,继续反应片刻,过滤(已知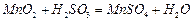 )。
)。
①石灰乳参与反应的化学方程式为?。
②反应过程中,为使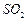 尽可能转化完全,在通入
尽可能转化完全,在通入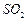 和
和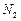 比例一定、不改变固液投料的条件下,可采取的合理措施有?、?。
比例一定、不改变固液投料的条件下,可采取的合理措施有?、?。
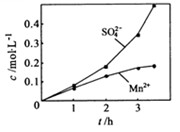
③若实验中将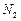 换成空气,测得反应液中
换成空气,测得反应液中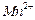 、
、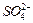 的浓度随反应时间t变化如下图。导致溶液中
的浓度随反应时间t变化如下图。导致溶液中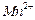 、
、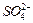 浓度变化产生明显差异的原因是?。
浓度变化产生明显差异的原因是?。
(2)制备高纯 固体:已知
固体:已知 难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;
难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解; 开始沉淀时
开始沉淀时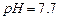 。请补充由(1)制得的
。请补充由(1)制得的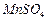 溶液制备高纯
溶液制备高纯 的操作步骤[实验中可选用的试剂:
的操作步骤[实验中可选用的试剂: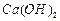 、
、 、
、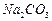 、
、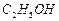 ]。
]。
①?;②?;③?;④?;⑤低于100℃干燥。
参考答案:

本题解析:略
本题难度:简单
3、选择题 下列有关实验操作的说法正确的是(?)
A.SO2通入酸性高锰酸钾溶液中,溶液褪色,说明SO2具有漂白性
B.用蒸馏水将PH试纸先润湿,可用于检验氨气
C.可用瓷坩埚熔化各种钠的化合物
D.某溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42-
参考答案:B
本题解析:A.SO2通入酸性高锰酸钾溶液中,溶液褐色,是由于二氧化硫将高锰酸钾还原为硫酸锰,致使其褪色,表现了二氧化硫的还原性:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+
B.氨气为碱性气体,可使润湿的pH试纸呈蓝色
C.瓷坩埚中的二氧化硅可与强碱(NaOH)反应:SiO2+2NaOH=Na2SiO3+H2O
D.若原溶液中含有SO32-离子,加Ba(NO3)2溶液,再加入稀盐酸,依然可得到不溶于酸的BaSO4沉淀(NO3—在酸性溶液中可将SO32-离子氧化为SO42-,进而生成BaSO4沉淀),故错误
答案为B
本题难度:一般
4、实验题 (共10分)化学上常用燃烧法确定有机物的组成.这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成.下图所列装置是用燃烧法确定有机物分子式常用的装置.

回答下列问题:
(1)产生的氧气按从左到右流向,所选装置各导管的连接序号(填写接口代号)是:
________________________________________;
(2)C装置中浓H2SO4的作用是________________________________;
(3)D装置中MnO2的作用是__________________________________;
(4)燃烧管中CuO的作用是___________________________________;
(5)若准确称取 0.90 g样品(只含 C、H、O三种元素中的两种或三种),经充分燃烧后,
A管质量增加1.32 g,B管质量增加0.54 g,则该有机物所含元素的最简比为___________。
参考答案:(1)g、f、e、h、i、c、d、a、b;(2)吸收水分,得干燥纯净的O2?(3)催化剂(4)使有机物充分氧化成CO2和H2O?(5)CH2O
本题解析:考查有机物分子式的确定。
D装置是生成氧气的,利用二氧化锰的催化作用使双氧水分解产生氧气。由于参与反应的氧气必须是纯净干燥的,所以需要对生成的氧气进行净化处理,用浓硫酸干燥氧气,然后和有机物反应。有机物的燃烧产物首先应该是用无水氯化钙来吸收生成的水,然后再用氢氧化钠吸收生成的CO2;有机物在燃烧过程中也可能燃烧不充分,从而生成CO,因此需要用氧化铜来氧化可能生成的CO;A管质量增加1.32 g,则CO2的质量是1.32g,物质的量是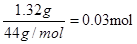 。B管质量增加0.54 g,则水是0.54g,物质的量是
。B管质量增加0.54 g,则水是0.54g,物质的量是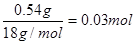 。所以有机物中氧原子的质量是0.90g-0.03mol×12g/mol-0.06mol×1g/mol=0.48mol,物质的量是0.03mol,所以C、H、O的个数之比是1︰2︰1,因此最简式是CH2O。
。所以有机物中氧原子的质量是0.90g-0.03mol×12g/mol-0.06mol×1g/mol=0.48mol,物质的量是0.03mol,所以C、H、O的个数之比是1︰2︰1,因此最简式是CH2O。
本题难度:一般
5、实验题 超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下
2NO+2CO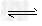 2CO2+N2
2CO2+N2
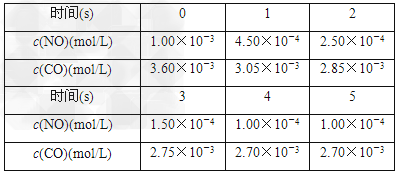
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的ΔH________0(填写“>”“<”“=”)。
(2)前2s内的平均反应速率v(N2)=________。
(3)在该温度下,反应的平衡常数K=________。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是________。
A.选用?更有效的催化剂
B.升高反应体系的温度
C.降低反应体系的温度
D.缩小容器的体积
(5)研究表明:在使用等质?量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
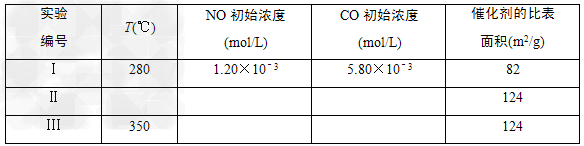
①请在上表空格中填入剩余的实验条件数据。
②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号。?
参考答案:(1)<
(2)1.875×10-4?mol/(L?s)
(3)5?000
(4)C、D
(5)①Ⅱ:280 ;1.20×10-3 ;5.80×10-3 Ⅲ:1.20×10-3 ;5.80×10-3
②如图: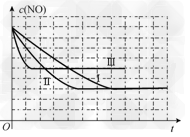
本题解析:
本题难度:困难