微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在CH3COOH溶液中存在如下平衡:CH3COOH 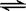 ?H++CH3COO-,加入少量下列固体物质能使平衡向左移动的是
?H++CH3COO-,加入少量下列固体物质能使平衡向左移动的是
A.NaCl
B.Na2CO3
C.CH3COONa
D.NaOH
参考答案:C
本题解析:略
本题难度:一般
2、选择题 下列叙述正确的是
A.液态HCl、固态NaCl均不导电,所以它们均为非电解质
B.NH3、SO3的水溶液均能导电,所以它们均为电解质
C.铜丝、石墨均能导电,所以它们均为电解质
D.蔗糖、乙醇在水溶液中或熔融状态下均不导电,所以它们均为非电解质
参考答案:D
本题解析:分析:在水溶液里或熔融状态下都导电的化合物是电解质,在水溶液和熔融状态下都不导电的化合物是非电解质,注意无论电解质还是非电解质都首先必须是化合物.
解答:A.液态氯化氢和固态氯化钠的水溶液都导电,所以氯化氢和氯化钠是电解质,故A错误;
B.氨气和三氧化硫的水溶液能导电,是因为氨气和水反应生成的一水合氨电离出阴阳离子,三氧化硫和水反应生成的硫酸电离出阴阳离子,所以一水合氨和硫酸是电解质,氨气和三氧化硫是非电解质,故B错误;
C.铜和石墨都是单质,既不是电解质也不是非电解质,故C错误;
D.蔗糖和乙醇在水溶液或熔融状态下都以分子存在,所以不导电,它们都是非电解质,故D正确;
故选D.
点评:本题考查电解质和非电解质的判断,根据概念来分析解答,易错选项是B,注意氨气和三氧化硫溶液导电的原因,为易错点.
本题难度:一般
3、选择题 已知0.1mol?L-1的醋酸溶液中存在电离平衡:CH3COOH?CH3COO-+H+,要使溶液中
的值增大,可以采取的措施是( )
①加少量烧碱溶液 ②升高温度 ③加少量冰醋酸 ④加水.
A.①②
B.①③
C.②④
D.③④
参考答案:①c(H+)c(CH3COOH)=Kac(CH3COO-),加少量烧碱溶液,溶液的酸性减弱,使醋酸的电离平衡正向移动,c(CH3COO-)增大,c(H+)c(CH3COOH)值减小,故①错误;
②弱电解质的电离过程是吸热的,升高温度促进电离,溶液中c(H+)增大,c(CH3COOH)降低,c(H+)c(CH3COOH)值增大,故②正确;
③c(H+)c(CH3COOH)=Kac(CH3COO-),加少量冰醋酸,使醋酸的电离平衡正向移动,c(CH3COO-)增大,c(H+)c(CH3COOH)值减小,故③错误;
④c(H+)c(CH3COOH)=n(H+)n(CH3COOH),加水促进电离,溶液中n(H+)增大,n(CH3COOH)降低,c(H+)c(CH3COOH)值增大,故④正确;
故选C.
本题解析:
本题难度:简单
4、选择题 下表是某铬酸(H2CrO4)溶液中离子浓度(mol·L-1)与pH的关系,下列说法不正确的是
pH
| c(CrO42-)
| c(HCrO4-)
| c(Cr2O72-)
| c(H2CrO4)
|
4
| 0.0003
| 0.1040
| 0.4480
| 0
|
6
| 0.0319
| 0.0999
| 0.4370
| 0
|
7
| 0.2745
| 0.0860
| 0.3195
| 0
|
9
| 0.9960
| 0.0031
| 0.0004
| 0
|
A.铬酸的第一步电离是完全电离
B.铬酸的第二步电离是部分电离,且存在两种电离方式
C.pH越大,电离出的CrO42-浓度越大
D.当电离达到平衡时,2v逆(Cr2O72-)= v正(HCrO4-)
参考答案:D
本题解析:A.pH=4时,c(H2CrO4)=0,说明铬酸的第一步电离是完全电离,故A正确;B.pH=4时,铬酸溶液中c(CrO42-)<c(HCrO4-),说明铬酸第二步电离是部分电离,HCrO4-?H++CrO42-,同时溶液中还存在2CrO42-+2H+?CrO72-+H2O,所以存在两个电离平衡,故B正确;C.根据表中数据知,pH越大,电离出的CrO42-浓度越大,故C正确;D.溶液中存在2CrO42-+2H+?CrO72-+H2O,当电离达到平衡状态时,2v逆(Cr2O72-)=v正(CrO42-),故D错误;故选D.
考点:弱电解质的电离平衡
本题难度:一般
5、选择题 H2S溶液中,在采取措施使pH增大的同时,则c(S2-)的变化情况是
A.增大
B.减小
C.不变
D.可能增大,也可能减小
参考答案:D
本题解析:降温,平衡逆向移动,PH增大,c(S2-)减小,加碱,则pH增大,c(S2-)也增大。选D。
本题难度:一般