微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 将一定量的CH4、O2和Na2O2放入一密封容器中,用电火花不断引燃混合气体,使其充分反应,反应结束后,容器内压强趋于0(固体物质蒸发不计),其残余固体溶于水无气体放出。
(1)有关Na2O2反应的化学方程式是:………
(2)CH4、O2、Na2O2的物质的量之比是…
(3)若混合气体中CH4为0.1mol,充分反应后,向残余固体中加足量的酸,能放出气体的物质的量是……
参考答案:1、2Na2O2+2CO2=2Na2CO3+O2
2Na2O2+2H2O=4NaOH+O2↑
2、2:1:6.
3、0.1mol.
本题解析:1、2Na2O2+2CO2=2Na2CO3+O2
2Na2O2+2H2O=4NaOH+O2↑
2、依题意,最后产物只能是Na2CO3和NaOH的混合物,根据原子守恒原理(尤其是CH4中C和H原子个数比为1:4),可得三者物质的量之比为2:1:6.
3、加酸后气体只有CO2,由C原子守恒可得,生成气体的物质的量为0.1mol.
本题难度:简单
2、选择题 将1 L 1.00 mol/L 的Na2CO3溶液逐滴加入到1 L 1.25 mol/L的盐酸中;再做相反操作:将1 L 1.25 mol/L的盐酸逐滴加入1 L 1.00 mol/L 的Na2CO3溶液中,两次操作产生的气体体积之比(同温同压下)是:(?)
A.1∶1
B.2∶1
C.5∶2
D.2∶5
参考答案:C
本题解析:(1)当把碳酸钠加入到盐酸中时由于盐酸相对来说过量,发生反应Na2CO3+2HCl= 2NaCl+H2O+CO2↑。n(HCl)="1.25" mol 所以放出气体0.625 mol 。(2)当把盐酸加入到碳酸钠溶液中时,.碳酸钠与盐酸反应分步进行。首先发生:Na2CO3+HCl= NaHCO3+NaCl;n(Na2CO3)="1.0mol" n(HCl)="1.25" mol消耗盐酸1.0mol.产生NaHCO31.0mol剩余盐酸0.25mol然后发生NaHCO3+HCl= NaCl+H2O+CO2↑。碳酸氢钠对于盐酸来说过量,反应产生的气体按照盐酸来求。盐酸0.25mol,所以产生CO2气体0.25mol。故两次操作产生的气体体积之比为0.625 mol:0.25mol=5:2.选项为 :C。
本题难度:一般
3、选择题 金属钠应存放于(? )
①煤油?②石蜡油?③四氯化碳?④密闭容器
A.①②③
B.②③④
C.①②④
D.①②③④
参考答案:C
本题解析:由于四氯化碳的密度大于金属钠,故钠若存放于四氯化碳中会漂浮在上面,容易与空气中的CO2和H2O发生反应而变质。
本题难度:一般
4、计算题 (4分)将4.6克钠加人到95.6克水中,反应完毕后。求:
1)产生的氢气在标况下的体积。
2)所得的氢氧化钠溶液的质量分数。
参考答案:2.24L? 8%
本题解析:由方程式2Na+2H2O=2NaOH+H2↑可知:4.6克钠也就是0.2mol完全与水反应,生成0.1mol氢气,0.2g,在标况下的体积为2.24L
所得NaOH溶液中溶质的质量为0.2×40=8g,溶液的质量为4.6+95.6-0.2=100g,溶液质量分数为8%
本题难度:一般
5、填空题 (8分)食盐和工业用盐具有广泛的用途。已知,工业盐含NaNO2,外观酷似食盐并有咸味。NaNO2有氧化性和还原性,遇酸分解放出NO2。
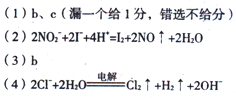
(1)下列试剂可鉴别工业盐和食盐的是?
a. H2O? b.酸性高锰酸钾溶液? c.盐酸
(2)NaNO2与氢碘酸反应(含氮产物为NO)的离子方程式为?.
(3)某工厂废液中含有2%—5%的NaNO2,直接排放会造成水污染,但加入下列物质中的某一种就 能使NaNO2中的氮转化为对空气无污染的气体,该物质是?
能使NaNO2中的氮转化为对空气无污染的气体,该物质是?
a.NaCl? b.NH4Cl? c.浓H2SO4
(4)氯碱工业通过电解饱和食盐水来获得相应的产物。请写出电解食盐水的离子方程式?。
参考答案:
本题解析:略
本题难度:一般