微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。(提示:碱石灰是生石灰与氢氧化钠的混合物,可以吸收水和二氧化碳)
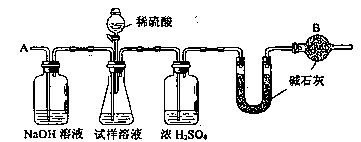
主要实验步骤如下:① 按图组装仪器,并检验装置的气密性
② 将10.0 g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③ 称量盛有碱石灰的U型管的质量,得到20.0g
④ 从分液漏斗滴入6mol·L-1的硫酸,直到不再产生气体时为止
⑤ 从导管A处缓缓鼓入一定量的空气
⑥ 再次称量盛有碱石灰的U型管的质量,得到22.0g
⑦ 重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为22.2g
请填空和回答问题:
(1)装置中干燥管B的作用? _________________________。如果没有连接该干燥管,测试的结果? (填偏高、偏低或不变)。
(2)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果? (填偏高、
偏低或不变)。
(3)步骤⑤的目的是? ___________________,如果没有进行步骤⑤的操作,测试的结果________________(填偏高、偏低或不变)。
(4)试样中纯碱的质量分数为___________________。
参考答案:(1)防止空气中的CO2和H2O进入U型管中(2分);偏高(2分)
(2)偏高(2分)
(3)把反应中的CO2全部导入U型管中(2分);偏低(2分)
(4)53.0%
本题解析:(1)U型管中的碱石灰是为了吸收反应生成的二氧化碳,但空气中也存在二氧化碳,干燥管B的作用就是防止空气中的二氧化碳和水分进入U型管,对结果产生误差,空气中的水和二氧化碳进入装置,被误认为是二氧化碳,所以二氧化碳的质量偏大,算出的碳酸钠的质量也会偏大的,所以结果会偏大;
答案为:防止空气中的CO2和水汽进入U型管中;偏高。
(2)由于盐酸具有挥发性,也会随着二氧化碳进入U型管,被误认为是二氧化碳,所以二氧化碳的质量偏大,算出的碳酸钠的质量也会偏大的,所以结果会偏大;
答案为:偏高;
(3)由于反应完了锥形瓶中存留有二氧化碳,鼓入一定量的空气就是将残留的二氧化碳完全排入U型管;没有步骤⑤,有残留的CO2没有反应,测试结果偏低。
答案为:把反应产生的CO2全部导入U型管中;偏低。
(4)设需要碳酸钠的质量为X则:
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑
106? 44
X? 22.2-20.0
列比例式: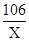 =
=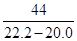
解得X=5.3g;
所以试样中纯碱的质量分数为
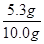 ×100%=53.0%;
×100%=53.0%;
答案:53.0%
本题难度:一般
2、选择题 在一定温度下,向饱和烧碱溶液中放入一定质量的过氧化钠,充分反应后,使之恢复到原来温度。下列说法正确的是?(?)
A.溶液中Na+浓度增大,有O2放出
B.溶液pH不变,有H2放出
C.溶液中Na+数目减少,有O2放出
D.溶液pH增大,有O2放出
参考答案:C
本题解析:略
本题难度:一般
3、选择题 将金属钾投入到氯化铁溶液中,产物是(?)
A.OH,H2
B.Fe(OH)3,KCl,H2
C.e,KCl
D.HCl,Fe(OH)3,KCl
参考答案:B
本题解析:金属钾首先与水反应,生产了氢气和氢氧化钾,氢氧化钾在与氯化铁反应生成了氢氧化铁沉淀和氯化钾,所以将金属钾投入到氯化铁溶液中,产物是Fe(OH)3,KCl,H2,故本题的答案选择B。
点评:本题考查了金属及其化合物,该考点是高考考查的热点,本题比较容易。
本题难度:一般
4、选择题 将1 L 1.00 mol/L 的Na2CO3溶液逐滴加入到1 L 1.25 mol/L的盐酸中;再做相反操作:将1 L 1.25 mol/L的盐酸逐滴加入1 L 1.00 mol/L 的Na2CO3溶液中,两次操作产生的气体体积之比(同温同压下)是:(?)
A.1∶1
B.2∶1
C.5∶2
D.2∶5
参考答案:C
本题解析:(1)当把碳酸钠加入到盐酸中时由于盐酸相对来说过量,发生反应Na2CO3+2HCl= 2NaCl+H2O+CO2↑。n(HCl)="1.25" mol 所以放出气体0.625 mol 。(2)当把盐酸加入到碳酸钠溶液中时,.碳酸钠与盐酸反应分步进行。首先发生:Na2CO3+HCl= NaHCO3+NaCl;n(Na2CO3)="1.0mol" n(HCl)="1.25" mol消耗盐酸1.0mol.产生NaHCO31.0mol剩余盐酸0.25mol然后发生NaHCO3+HCl= NaCl+H2O+CO2↑。碳酸氢钠对于盐酸来说过量,反应产生的气体按照盐酸来求。盐酸0.25mol,所以产生CO2气体0.25mol。故两次操作产生的气体体积之 91EXAM.org比为0.625 mol:0.25mol=5:2.选项为 :C。
本题难度:一般
5、实验题 某实验小组欲通过以下实验来探究Na2CO3和NaHCO3两种物质的性质。
(1)称取两种固体各2 g,分别放入两个小烧杯中,再各滴加10 mL 蒸馏水,振荡,测量温度变化;待固体充分溶解,并恢复至室温后,向所得溶液中各滴入2滴酚酞试液。
① 发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得到结论?。
② 同学们在两烧杯中还观察到了其它现象。其中,盛放Na2CO3的烧杯中出现的现象是?(填字母序号)。
A.溶液温度下降? B.溶液温度升高? C.滴入酚酞后呈浅红色?D.滴入酚酞后呈红色
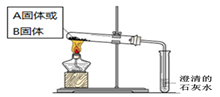
(2)如下面左图所示分别加热A、B固体,发现固体A受热产生的气体能使澄清石灰水变浑浊,但一段时间后浑浊又变澄清。请用化学方程式解释澄清石灰水中发生的现象?。
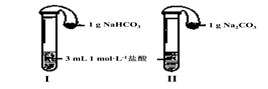
(3)如上图所示,在气密性良好的装置I和II中分别放入试剂,将气球内的固体同时倒入试管中。
两试管中均产生气体,?(填“I”或“II”)的反应程度更为剧烈。
② 反应结束后,气球均有膨胀,恢复至室温。下列说法正确的是?。
A.装置I的气球体积较大? B.装置II的气球体积较大
C.生成气体的体积根据盐酸计算? D.生成气体的体积根据固体计算
(4)将两种固体分别配制成0.5 mol·L-1的溶液,探究与0.5 mol·L-1CaCl2溶液反应的情况
实验方案
| 预测现象
| 预测依据
| 实际结果
|
实验1:向2 mL Na2CO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液
| 有白色
沉淀
| Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应。
| 有白色沉淀
|
实验2:向2 mL NaHCO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液
| 无白色
沉淀
| NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应。
| 有白色沉淀出现,同时有少量气泡冒出。
|
?
请写出上述实验过程中发生的反应的离子方程式:
实验1:?;实验2:?。
参考答案:(1)①同温度下,Na2CO3比NaHCO3易溶于水(2分,不说明温度条件的扣1分)
②B、D(2分)
(2)Ca(OH)2+CO2=CaCO3↓+H2O(2分)? CaCO3+CO2+H2O=Ca(HCO3)2(2分)
(3)①Ⅰ(2分)?(2)A、C(2分,少选1个得1分,错选、不选不得分)
(4)实验1:Ca2++CO32-=CaCO3↓(2分)?实验2:Ca2++2HCO3-=CaCO3↓+CO2↑+H2O(2分)
本题解析: (1)本题探究的Na2CO3和NaHCO3两种物质都是我们中学阶段非常熟知的两种钠盐,这两种物质进行对比,很多性质可以直接结合我们所学内容得出。此处称取等量的两种物质溶解,发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,说明在相同温度下Na2CO3固体的溶解度要大于NaHCO3固体。这两种钠盐溶解均是放热的,所以会使体系温度升高。同时它们均是强碱弱酸盐,水解呈碱性使酚酞变红。故选BD。
(2)NaHCO3 受热易分解产生CO2,使澄清石灰水变浑浊,但是通了一段时间的CO2后,产生的沉淀CaCO3又与过量的CO2反应生成了可溶的Ca(HCO3)2,所以溶液又变澄清。整个过程发生的反应方程式为:Ca(OH)2+CO2=CaCO3↓+H2O?、 CaCO3+CO2+H2O=Ca(HCO3)2?。
(3)①②Na2CO3和NaHCO3两种物质均能与HCl反应产生CO2气体,但是反应中CO32- 要先与H+反应生成HCO3-,然后再由HCO3-与H+反应生成CO2,经过2个步骤,所以装置I反应要慢,装置II要跟更为剧烈。
②所得气球的体积大小主要看反应生成的CO2气体的体积,根据C原子守恒,1g的Na2CO3和1g NaHCO3 中,NaHCO3 能生成的CO2物质的量大,所以产生的气体多,故A正确;此实验中盐酸均完全反应,所以气体体积根据盐酸来计算,故C正确;故选AC。
(4)实验1中产生白色沉淀是由于钙离子和碳酸根离子结合生成了碳酸钙沉淀,所以离子方程式为:
Ca2++CO32-=CaCO3↓;而实验2中理论上HCO3-与Ca2+ 不能反应,没有沉淀生成,但是由实际结果推测HCO3-发生微弱电离产生CO32-和H+,电离产生的CO32-与Ca2+ 结合生成了碳酸钙沉淀,同时进一步促进了电离,使得电离产生的H+又与溶液中的HCO3-反应生成CO2气体,所以离子方程式为:Ca2++2HCO3-=CaCO3↓+CO2↑+H2O。
本题难度:一般