微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法不正确的是(?)
A.硅的导电性能介于金属和绝缘体之间,是良好的半导体材料
B.硅是非金属元素,但它的单质具有金属光泽
C.二氧化硅的化学性质不活泼,常温下难与盐酸起反应
D.自然界中存在大量单质硅,其含量仅次于氧
参考答案:D
本题解析:本题考查硅及其化合物的基本性质。自然界存在大量的硅元素,其含量仅次于氧,但自然界没有游离的硅,硅元素都是以化合态存在的,如硅酸盐、二氧化硅等,故D选项错误。
本题难度:简单
2、填空题 过碳酸钠(Na2CO4)和稀硫酸反应的化学方程式为:2Na2CO4 +2H2SO4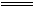 2Na2SO4+O2↑+2H2O+2CO2↑
2Na2SO4+O2↑+2H2O+2CO2↑
某过碳酸钠样品中含有少量Na2O2,甲、乙两位同学各称质量为mg的该样品,选用下图所示的仪器组合成测定样品的纯度的装置。仪器的连接顺序,甲是①⑦③⑥④;乙是①②。
 ?
?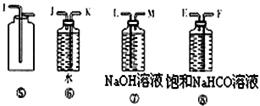
(1)甲同学想通过实验测得的数据是?。他连接装置的顺序存在错误,调整的方法是?。
(2)乙同学想通过实验测得的数据是?。按他测得的数据计算出来的实验结果?(填“偏高”、“偏低”或“无影响”),理由是?。
(3)为了测得准确的实验数据,请你将乙同学的实验装置进行改进,写出各接口的连接顺序:?。
(4)按你改进的实验装置进行实验,若测得实验前后装置②的质量分别是W1g和W2g,则样品中过碳酸钠的质量分数为?。
参考答案:(1)CO2的质量和O2的体积?⑦与③交换位置







(2)CO2的质量?偏高?碱石灰吸收了水蒸气
(3)A接H,G接B?(4)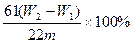
本题解析:实验的目的是测定Na2CO4样品的纯度,可能含有少量Na2O2。Na2CO4和稀硫酸反应、Na2O2和稀硫酸反应均有O2放出,实验可通过测定CO2的质量来求算Na2CO4的纯度,在用碱石灰吸收CO2之前,需先除去CO2中的水蒸气,否则实验测得的数据会偏高,故甲同学的实验中⑦与③应交换位置,乙同学应增加③浓硫酸。
本题难度:一般
3、选择题 继科学家发现C3O2是金星大气的成分后,2004年美国科学家通过“勇气”号太空探测出火星大气中含有 一种称为硫化羰(化学式为COS)的物质。已知硫化碳与二氧化羰的结构相似,但有明显的还原性,在氧气中会燃烧。下列说法中不正确的是
[? ]
A.C3O2与CO一样可以在氧气中燃烧生成CO2
B.C3O2、CO与CO2都是碳的氧化物
C.硫化羰在氧气中完全燃烧的产物是CO2和SO2
D.火星大气中可能有大量氧气存在
参考答案:D
本题解析:
本题难度:简单
4、填空题 (12分)回收再利用锗产品加工废料,是生产GeO2的重要途径,其流程如下图。
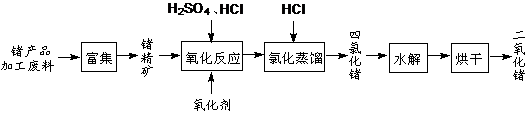
(1)Ge2+与氧化剂H2O2反应生成Ge4+,写出该反应的离子方程式:?
? ▲?。
(2)蒸馏可获得沸点较低的GeCl4,在此过程中加入浓盐酸的原因是:?
?▲?。
(3)GeCl4水解生成GeO2·nH2O,此过程用化学方程式可表示为:? ▲?。温度对GeCl4的水解率产生的影响如右图所示。为控制最佳的反应温度,实验时可采取的措施为?▲?。(填字母)
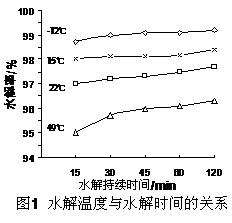
A.用冰水混合物?B.49℃水浴 ?C.用冰盐水
(4)根据下表1 中不同pH下二氧化锗的溶解率,结合Ge在元素周期表中的位置及“对角线”法则,分析GeO2溶解率随pH 变化的原因?▲?,用离子方程式表示pH>8时GeO2溶解率增大可能发生的反应?▲?。
表1?不同pH下二氧化锗的溶解率
pH
| 4
| 5
| 6
| 7
| 8
| 9
|
溶解率/%
| 47.60
| 32.53
| 11.19
| 5.27
| 1.96
| 8.85
参考答案:(1)Ge2++H2O2+2H+=Ge4++2H2O (2)抑制GeCl4水解
(3)GeCl4+ (2+n) H2O = GeO2·nH2O+ 4HC1?C
(4)二氧化锗具有两性,? GeO2+2OH-?=GeO+H2O
本题解析:
(1)根据氧化还原反应的本质:锗的失去电子,化合价上升;则氧得到电子,化合价下降生成水。再根据化学反应前后原子守恒,可配平化学反应:Ge2++H2O2+2H+=Ge4++2H2O
(2)-(3):由于GeCl4强酸弱碱盐,在加热的很容更易发生水解反应,即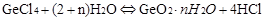 ,当加入浓盐酸可以抑制反应向右进行,即抑制水解。温度越低越不利于水解反应,冰盐水可以降低冰的凝固点,使温度更低。所以选C。 ,当加入浓盐酸可以抑制反应向右进行,即抑制水解。温度越低越不利于水解反应,冰盐水可以降低冰的凝固点,使温度更低。所以选C。
(4)锗的对角是铝,氧化铝是两性金属氧化物,既可以与酸反应,又可以与碱反应。所以氧化锗是两性氧化物,既可以与酸反应,又可以与碱反应,且酸碱性越强反应越剧烈。当pH>8时,生成偏锗酸盐和水,即GeO2+2OH-?=GeO32-+H2O。
本题难度:困难
5、选择题 石灰石中含主要杂质为石英,该石灰石在下列工业生产中其杂质也参加有益的化学反应的是?
A.烧制石灰
B.制普通玻璃
C.炼铁
D.制铜
参考答案:B
本题解析:普通玻璃的原料是纯碱、石灰石和石英,原料加强热熔融后,主要反应是:
Na2CO3+SiO2 Na2SiO3+CO2↑ Na2SiO3+CO2↑
CaCO3+SiO2 CaSiO3+CO2↑ CaSiO3+CO2↑
因此,石英是参加有益的反应,B对。
本题难度:一般
|