微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 在恒温恒容的密闭容器中,工业上常用反应①制备甲醇:CO(g)+2H2(g)?CH3OH(g)△H1<0;其中的原料气常用反应②来制备:CH4(g)+H2O(g)?CO(g)+3H2(g)△H2.根据题意完成下列各题:
(1)判断反应①达到平衡状态的标志是______(填字母).
a.CO体积分数保持不变
b.CO和CH3OH浓度相等
c.容器中气体的压强不变
d.CH3OH的生成速率与CO的消耗速率相等
e.容器中混合气体的密度保持不变
(2)欲提高反应①CO中的转化率,下列措施可行的是______(填字母).
a.向装置中再充入N2
b.升高温度
c.改变反应的催化剂
d.向装置中再充入H2
(3)一定条件下,反应②中CH4的平衡转化率与温度的关系如图所示.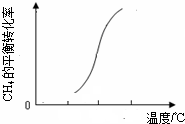 则△H2______0(填“<”、“>”或“=”).在T℃时的1L密闭容器中,充入1molCH4和3molH2O(g),发生反应②,经过5min达到平衡,此时CH4的转化率为50%,则从开始到平衡,H2的平均反应速率为______,T℃时该反应的平衡常数为______;
则△H2______0(填“<”、“>”或“=”).在T℃时的1L密闭容器中,充入1molCH4和3molH2O(g),发生反应②,经过5min达到平衡,此时CH4的转化率为50%,则从开始到平衡,H2的平均反应速率为______,T℃时该反应的平衡常数为______;
(4)若向此1L密闭容器中,加入1molCH4、5molH2O(g)、1molCO和3molH2,发生反应②,若温度仍为T℃,此时v(正)______v(逆)(填“<”、“>”或“=”).若改变反应温度,达到新平衡时,______mol<n(H2O)<______mol.
参考答案:(1)恒温恒容的容器内进行反应CO(g)+2H2(g)?CH3OH(g)
a.平衡状态各组分的含量不变,CO体积分数保持不变,证明反应达到平衡,故a正确;
b.甲醇和一氧化碳的起始量和消耗量决定,容器中甲醇浓度与CO浓度相等不能证明反应达到平衡,故B错误;
c.反应前后是气体体积减小的反应,容器中气体的压强不变,说明反应达到平衡状态,故c正确
d.化学反应速率之比等于化学方程式中计量数之比,CH3OH的生成速率与CO的消耗速率相等,说明甲醇和一氧化碳正反应速率相同,反应正向进行不能说明反应达到平衡,故d错误;
e.容器中混合气体的密度保持不变,混合气体的密度=气体质量气体体积,反应过程中气体质量守恒,容器体积相同,密度不变,不能证明反应达到平衡,故e错误;
故答案为:ac;
(2)CO(g)+2H2(g)?CH3OH(g),
a.向装置中再充入N2,恒温恒容条件下,体系总压增大,分压不变,平衡不动,故a不符合;
b.反应是放热反应,升高温度平衡那你想进行,转化率减小,故b不符合;
c.改变反应的催化剂,改变反应速率,不能改变化学平衡,转化率不变,故c不符合;
d.向装置中再充入H2,提高一氧化碳转化率,故d正确;
故答案为:d;
(3)图象变化分析甲烷转化率随温度升高增大,说明平衡正向进行,正反应是吸热反应,△H>0,在T℃时的1L密闭容器中,充入1mol CH4和3mol H2O(g),发生反应②,经过5min达到平衡,此时CH4的转化率为50%,则
CH4(g)+H2O(g)?CO(g)+3H2(g)
起始量(mol) 1 3 0 0
变化量(mol)0.5 0.5 0.5 1.5
平衡量(mol)0.5 2.5 0.5 1.5
H2的平均反应速率=1.5mol1L5min=0.3mol/L?min;
平衡常数K=(1.51)3×0.50.5×2.5=1.35(mol/L)2;
故答案为:>;0.3mol/L?min,1.35;
(4)若向此1L密闭容器中,加入1mol CH4、5mol H2O(g)、1mol CO和3mol H2,发生反应②,若温度仍为T℃.平衡常数K=1.35,Qc=1×331×5=5.4>1.35,所以反应逆向进行,v(正)<v(逆),若改变反应温度,达到新平衡时,
CH4(g)+H2O(g)?CO(g)+3H2(g)
15 1 3
0 4 2 4
26 0 2
得到水蒸气的物质的量介于4-6间;
故答案为:<;4;6.
本题解析:
本题难度:简单
2、填空题 某化学反应2A (g) ≒ B(g) + D(g) 在4种不同条件下进行,B和D的起始浓度为0 ,反应物A 的浓度(mol?L-1) 随反应时间 (min) 的变化情况如下表:?
?
实验
序号
| 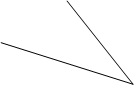 浓度 浓度
时间
温度
| 0
| 10
| 20
| 30
| 40
| 50
| 60
|
1
| 800℃
| 1.0
| 0.80
| 0.67
| 0.57
| 0.50
| 0.5 0 0
| 0.50
|
2
| 800℃
| 1.0
| 0.60
| 0.50
| 0.50
| 0.50
| 0.50
| 0.50
|
3
| 800℃
| C3
| 0.92
| 0.75
| 0.63
| 0.60
| 0.60
| 0.60
|
4
| 820℃
| 1.0
| 0.40
| 0.25
| 0.20
| 0.20
| 0.20
| 0.20
|
根据上述数据,完成下列填空:
(1)实验1达到平衡的时间是?min,实验4达到平衡的时间是?min,C3??1.0 mol?L-1(填“< ”、“ > ”或“ = ” )。
(2)实验4比实验1的反应速率?(填“快”或“慢”),原因是?。
(3)如果2A (g) ≒ B(g) + D(g) 是一个放热反应,那么实验4与实验1相比,??放出的热量多,理由是?。
参考答案:(1)40?、? > ?
(2)快?、?温度较高。
(3) 4 、反应的量较多
本题解析:略
本题难度:简单
3、选择题 在一固定容积的容闭容器中,加入2 L X 和3 L Y 气体,发生如下反应:
n X(g) + 3Y(g)  2Z(g) + R(g),反应平衡时,则知X 和Y 的转化率分别为30%和60%,
2Z(g) + R(g),反应平衡时,则知X 和Y 的转化率分别为30%和60%,
则化学方程式中的n 值为
A.1
B.2
C.3
D.4
参考答案:A
本题解析:由题目可得出X 和Y 转化的体积比为:0.6:1.8=1:3,此比例和方程式系数比相同,故n=1,答案为A
本题难度:简单
4、选择题 下列说法不正确的是?
A.明矾净水的原理是Al3+水解产生Al(OH)3胶体,Al(OH)3胶体能吸附水中的悬浮杂质,并使之沉降
B.摩尔盐的制备原理为:6H2O+FeSO4+(NH4)2SO4=(NH4)2Fe(SO4)?6H2O,反应之所以能进行的原因是(NH4)2Fe(SO4)?6H2O溶解度最小
C.镀锌铁皮在酸中溶解,当镀层反应完全时,产生氢气的速率会突然减慢
D.将火柴头直接浸入品红溶液中,可以检验火柴头中是否含有硫元素
参考答案:D
本题解析:
答案:D
A.正确,明矾净水的原理是Al3+水解产生Al(OH)3胶体,Al3++3H2O Al(OH)3+3H+ ,Al(OH)3胶体能吸附水中的悬浮杂质,并使之沉降
Al(OH)3+3H+ ,Al(OH)3胶体能吸附水中的悬浮杂质,并使之沉降
B.正确,摩尔盐的制备原理为:6H2O+FeSO4+(NH4)2SO4=(NH4)2Fe(SO4)?6H2O,反应之所以能进行的原因是(NH4)2Fe(SO4)?6H2O溶解度最小,达到饱和后能从溶液中析出。
C.正确,镀锌铁皮在酸中溶解,当镀层反应完全时,不再形成原电池,反应速率变慢,产生氢气的速率会突然减慢
D.不正确,将火柴头直接浸入品红溶液中,无法检验火柴头中是否含有硫元素,可将它燃烧后,将生成的气体通入品红溶液。
本题难度:一般
5、选择题 下图是可逆反应X2+3Y2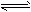 2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是
2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是
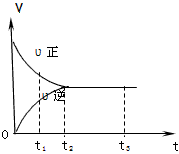
[? ]
A.t1时,只有正方向反应
B.t2时,X2、Y2、Z2的物质的量相等
C.t2- t3,反应不再发生
D.t2- t3,各物质的浓度不再发生变化
参考答案:D
本题解析:
本题难度:一般