微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (13分)(1)常温下,0.05mol/L硫酸溶液中,c(H+)=?mol/L,pH值为?,水电离的c(H+)=?mol/L。如图所示,一定温度下,冰醋酸加水稀释过程中溶液的导电能力曲线图,请回答。

(2)“O”点为什么不导电?。
(3)a、b、c三点的氢离子浓度由小到大的顺序为?。
(4)a、b、c三点中,醋酸的电离程度最大的一点是?。
(5)若使c点溶液中的c(CH3COO-)提高,在如下措施中,可选择?。
A.加NaCl溶液?B.加热?
C.加固体KOH?D.加Zn粒
E.加固体CH3COONa ? F.加水
(6)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是__________________。
A.H+个数?B.c(H+)
C.c(H+)/c(CH3COOH)? D.CH3COOH分子数
参考答案:(1)0.1 mol/L? 1? 10-13 mol/L?(2)因为冰醋酸未电离,无自由移动的离子
(3)c<a<b ?(4)c ?(5)B、C、D、E?(6)A、C
本题解析:(1)0.05mol/L硫酸溶液中c(H+)=0.1 mol/L,pH值为1,水电离的c(H+)为10-13 mol/L。
(2)在O点醋酸没有电离,只有醋酸分子,无自由移动的离子,所以不能导电。
(3)氢离子浓度越大,导电能力越强,所以根据图像可知氢离子浓度的大小顺序为b>a>c。
(4)醋酸是弱酸,存在电离平衡,稀释促进电离,所以c点醋酸的电离程度最大。
(5)根据CH3COOH CH3COO-+H+,加NaCl溶液,平衡不移动c(CH3COO-)不变,加热平衡正向移动,c(CH3COO-)增大,加固体KOH,平衡正向移动,c(CH3COO-)增大,加Zn粒,平衡正向移动,c(CH3COO-)增大,加固体CH3COONa,平衡逆向移动,但c(CH3COO-)增大,加水平衡正向移动,但c(CH3COO-)减小。所以能使c(CH3COO-)增大的措施是BCDE。
CH3COO-+H+,加NaCl溶液,平衡不移动c(CH3COO-)不变,加热平衡正向移动,c(CH3COO-)增大,加固体KOH,平衡正向移动,c(CH3COO-)增大,加Zn粒,平衡正向移动,c(CH3COO-)增大,加固体CH3COONa,平衡逆向移动,但c(CH3COO-)增大,加水平衡正向移动,但c(CH3COO-)减小。所以能使c(CH3COO-)增大的措施是BCDE。
(6)根据CH3COOH CH3COO-+H+,稀释过程中平衡正向移动,H+个数增加,c(H+)减小,c(CH3COO-)减小,CH3COOH分子数减小,根据K=
CH3COO-+H+,稀释过程中平衡正向移动,H+个数增加,c(H+)减小,c(CH3COO-)减小,CH3COOH分子数减小,根据K=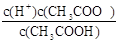 ,c(CH3COO-)减小,所以
,c(CH3COO-)减小,所以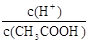 增大。因此选AC。
增大。因此选AC。
点评:本题综合性较强,难度较大,主要要运用好平衡常数。
本题难度:一般
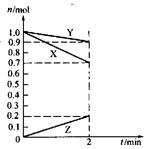
2、选择题 某温度时,在2L容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。由图中数据分析:该反应的化学方程式为_________________。反应开始至2min,用Z表示的平均反应速率为____________。
参考答案:3X+Y=2Z?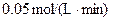
本题解析:由图可知,X、Y的物质的量随反应的进行而减小,Z的物质的量随反应的进行而增大,则X和Y为反应物,Z为生成物。
∵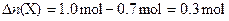
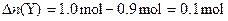
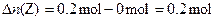
∴反应方程式为:3X+Y=2Z。
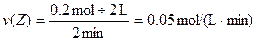
本题难度:一般
3、计算题 在一个容积为500 mL的密闭容器中,充入5 mol H2和2 mol CO。在一定条件下,发生如下反应 ,经过5 min后达到平衡状态。若此时测得CH3OH蒸气的浓度为2 mol /L,求:
,经过5 min后达到平衡状态。若此时测得CH3OH蒸气的浓度为2 mol /L,求:
(1)以H2的浓度变化表示该反应的速率。
(2)达平衡时CO的转化率。
参考答案:(1)? V(H2) = 0.8moL·L-1·min-1 ?(2)? 50%
本题解析:略
本题难度:一般
4、选择题 对于可逆反应:A2(g)+3B2(g) 2AB3(g);△H<0,下列图象中正确的是(?)
2AB3(g);△H<0,下列图象中正确的是(?)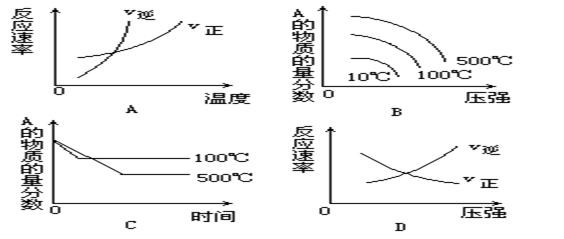
参考答案:AB
本题解析:考查外界条件对反应速率及平衡的越影响。根据反应式可知,这是1个体积减小的、发热的可逆反应。升高温度平衡向逆反应方向移动,反应物的含量增大,A正确。增大压强平衡向正反应方向移动,反应物的含量降低,B正确。温度高,反应速率快,到达平衡的时间段,所以选项C是错误的。增大压强,正逆反应速率均是增大的,选项D不正确。答案选AB。
本题难度:简单
5、选择题 下列溶液导电能力最强的是
A.0.1 mol·L-1的氨水100 mL
B.0.1 mol·L-1的醋酸50 mL
C.0.05 mol·L-1的醋酸100 mL
D.0.05 mol·L-1的硫酸100 mL
参考答案:D
本题解析:溶液的导电性只与溶液中离子浓度和离子所带电荷数有关系,离子的浓度越大,电荷数越多,则溶液的导电性压强。在选项中只有硫酸是强酸,溶液的酸性最强,所以溶液的导电性最强,答案选D。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,难易适中。在注重对基础知识考查与训练的同时,侧重对学生灵活运用基础知识解决实际问题的能力的培养,有利于培养学生的逻辑推理能力,提升学生的学科素养。
本题难度:简单