微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将一块铁片放入500mL,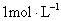 的
的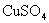 溶液中,反应一段时间后,取出铁片,小心洗净后干燥称量,铁片增重0.8g,反应后溶液中
溶液中,反应一段时间后,取出铁片,小心洗净后干燥称量,铁片增重0.8g,反应后溶液中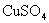 的物质的量浓度是( )
的物质的量浓度是( )
A.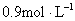
B.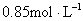
C.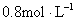
D.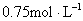
参考答案:C
本题解析:考查挖掘关系量及缜密思维能力。
解题思路:以方程式挖掘新的关系量,先求反应的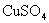
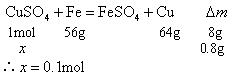
剩余
∴
答案:C
差量法是化学计算中常用的一种方法。所谓差量法是指一个过程中某物质始态量与终态量的差值,它可以是质量差、物质的量差、物质的量浓度差、气体的体积差。
本题难度:简单
2、计算题 有14.0g Na2O和Na2O2的混合物,加足量的水使之充分反应,得到标况下气体的体积为1.12L。此时所得溶液的体积恰好为100mL,请计算:
(1)混合物中各组分的质量。
(2)所得溶液中溶质的物质的量浓度。
参考答案:(10分)
(1)m(Na2O)=6.2g(3分),m(Na2O2)=7.8g(3分)
(2)c(NaOH)=4.0mol/L(4分)
本题解析:(1)因为混合物中只有氢氧化钠与水反应产生氧气,利用氧气的体积计算过氧化钠的质量,从而计算氧化钠的质量。设混合物中过氧化钠的物质的量是x,标准状况下氧气的物质的量是1.12L/22.4L/mol=0.05mol,则
2Na2O2+2H2O=4NaOH+O2↑
1
x 0.05mol,
所以2:1=x:0.05mol,x=0.1mol,则Na2O2的质量是0.1mol×78g/mol=7.8g,所以Na2O的质量是14.0g-7.8g=6.2g;
(2)根据Na2O的质量可计算Na2O的物质的量是6.2g/62g/mol=0.1mol,与水反应后的溶液为NaOH溶液,根据Na元素守恒,NaOH的物质的量是(0.1mol+0.1mol) ×2=0.4mol,所以NaOH的物质的量浓度为0.4mol/0.1L=4.0mol/L。
考点:考查化学方程式的计算
本题难度:一般
3、简答题 现要配制500ml?1mol/L的硫酸溶液,需用质量分数为98%、密度为1.84g/cm3的浓硫酸.若实验遇到下列情况,对硫酸溶液的物质的量浓度有何影响?(填“偏高”“偏低”或“不变”)
(1)用于稀释硫酸的烧杯未洗涤,______;
(2)未经冷却趁热将溶液注入容量瓶中定容,______;
(3)摇匀后发现液面低于刻度线再加水,______;
(4)容量瓶中原有少量蒸馏水,______;
(5)定容时观察液面俯视,______.
参考答案:(1)烧杯壁、玻璃棒上都沾有少量的硫酸,用于稀释硫酸的烧杯未洗涤,移入容量瓶内溶质硫酸的物质的量减小,所配溶液的浓度偏低,故答案为:偏低;
(2)溶液具有热胀冷缩的性质,未经冷却趁热将溶液注入容量瓶中定容,溶液冷却后所配溶液的体积偏小,导致所配溶液的浓度偏高,故答案为:偏高;
(3)摇匀后少量溶液残留在瓶塞与瓶口之间,再加水导致所配溶液的体积偏大,所配溶液的浓度偏低,故答案为:偏低;
(4)溶液配制需加水定容,容量瓶中有少量蒸馏水,对所配溶液浓度无影响,浓度不变,故答案为:不变;
(5)定容时观察液面俯视,导致所配溶液的体积偏小,所配溶液的浓度偏高,故答案为:偏高.
本题解析:
本题难度:一般
4、填空题 (1)CO2的摩尔质量为 ;
88 g CO2的物质的量为 ,所含二氧化碳分子数为 ,
在标准状况下的体积约为 。
(2)某化学兴趣小组对“农夫山泉”矿泉水进行检测时,发现1.0 L该矿泉水中含有45.6 mgMg2+,则Mg2+的物质的量浓度为 。
(3)体积比为1∶1∶1的氯化钠、氯化镁和氯化铝溶液,分别加入等体积、等浓度的硝酸银溶液,均恰好完全反应生成氯化银沉淀,则这三种溶液的物质的量浓度之比为_________。
参考答案:(12分)(1)44 g·mol-1,2 mol, 2NA或1.204×1024个, 44.8L;
(2)1.9×10-3 mol·L-1。 (3)6:3:2 (每空2分)
本题解析:
(1)CO2的摩尔质量为44 g·mol-1;
88 g CO2的物质的量为2 mol,所含二氧化碳分子数为2NA或1.204×1024个,
在标准状况下的体积约为44.8L。
(2)某化学兴趣小组对“农夫山泉”矿泉水进行检测时,发现1.0 L该矿泉水中含有45.6 mgMg2+,则Mg2+的物质的量浓度为1.9×10-3 mol·L-1。
(3)体积比为1∶1∶1的氯化钠、氯化镁和氯化铝溶液,分别加入等体积、等浓度的硝酸银溶液,均恰好完全反应生成氯化银沉淀,则这三种溶液的物质的量浓度之比为6:3:2。
考点:和物质的量有关的计算
点评:和物质的量有关的计算中常用的公式是:m=n×M; v=n×vm ; N=NA×n; c=n/v,只要熟悉这些公式使用的条件和注意事项,此题便不难解决。
本题难度:一般
5、选择题 质量相等的下列物质中,含分子数最多的是 ( )
A.H2
B.O2
C.NH3
D.CO2