微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 填写下列空白:
(1)写出表示含有8个质子、10个中子的原子的化学符号:______;
(2)周期表中最活泼的非金属元素位于第______族;
(3)所含元素种类是8种的周期是第______、______周期.
参考答案:(1)质子数为8的原子为氧原子,则含8个质子、10个中子的原子的质量数=8+10=18,化学符号为188O,
故答案为:188O;
(2)非金属强的元素在元素周期表中的右上方的位置,在每个周期中第ⅦA族元素的非金属性最强,在第ⅦA族中Cl元素的非金属性最强,故答案为:ⅦA;
(3)短周期包括一、二、三周期,第一周期有2种元素,第二、三周期都含有8种元素,故答案为:二;三.
本题解析:
本题难度:一般
2、选择题 氯化硼(BCl3)的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120o,它能水解,有关叙述正确的是(?)
A.氯化硼液态时能导电而固态时不导电
B.氯化硼加到水中使溶液的pH升高
C.氯化硼分子呈正三角形,属非极性分子
D.氯化硼B-Cl之间是sp3形成的σ键
参考答案:C
本题解析:氯化硼的熔沸点低,因此形成的晶体是分子晶体。又因为分子中键与键之间的夹角为120o,所以是平面三角形结构,则属于非极性分子,采用的sp2杂化。水解生成氯化氢和氢氧化硼,溶液显酸性,ABD不正确,则答案选C。
点评:该题是中等难度的试题,试题基础性强,主要是考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的创新思维能力和知识的迁移、类推能力。
本题难度:一般
3、简答题 有A、B、C、D、W五种元素.W的原子序数为29,其余的均为短周期主族元素;其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有两个未成对的电子;C元素氢化物与其最高价氧化物对应水化物之间反应生成一种盐;D原子核内的质子数与中子数相等,能与B形成DB2、DB3常见化合物.根据以上条件,回答下列问题:
(1)推断元素名称:A______.
(2)C元素的氢化物的空间构型为______,分子中的化学键______(填“有”或“无”)极性,其分子为______分子(填“极性”或“非极性”).
(3)比较A、B、C三种元素的第一电离能由大到小的顺序______(用元素符号表示),A、B、C三种元素的氢化物的沸点高低______(用化学式表示).
(4)写出D元素原子基态时的电子排布式______,其在元素周期表中的位置______.
(5)W元素+2价离子的水溶液呈现天蓝色,是该离子与水分子通过______键形成的______(填化学式)而显示出的颜色.
参考答案:有A、B、C、D、W五种元素.W的原子序数为29,则W为Cu元素;其余的均为短周期主族元素,C元素氢化物与其最高价氧化物对应水化物之间反应生成一种盐,则C为N元素;A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数,则外围电子排布为2s22p2,则A为碳元素;B原子最外层中有两个未成对的电子,其最外层电子数不能为4,则外围电子排布为2s22p4,故B为氧元素;D原子核内的质子数与中子数相等,能与O元素形成DO2、DO3常见化合物,则D为硫元素,
(1)由上述分析可知,A为碳,故答案为:碳;
(2)C元素的氢化物为NH3,N原子成3个N-H键、含有1对孤对电子,采取SP3杂化,为三角锥型结构,N-H为极性键,分子不对称,为极性分子;
故答案为:三角锥型;有;极性;
(3)同周期自左而右第一电离能呈增大趋势,N原子2p能级有3个电子,处于半满稳定状态,电子能量降低,第一电离能高于同周期相邻元素,故第一电离能N>O>C;常温下水为液体,沸点最高,氨气、甲烷常温下为气体,氨气分子中存在氢键,沸点比甲烷高,故沸点H2O>NH3>CH4,
故答案为:N>O>C;H2O>NH3>CH4;
(4)S元素原子核外有16个电子,基态时的电子排布式1s22s22p63s22p4,处于元素周期表中第三周期第ⅥA族,
故答案为:1s22s22p63s22p4;第三周期第ⅥA族;
(5)Cu2+与水分子通过配位键形成[Cu(H2O)4]2+而显示出的颜色,故答案为:配位键;[Cu(H2O)4]2+.
本题解析:
本题难度:简单
4、选择题 CH4和P4分子都是正四面体构型,则下列关于它们的说法中正确的是
[? ]
A.CH4和P4中的键角为109°28"
B.CH4和P4中的键角为60°
C.CH4中的键角为109°28"
D.P4中的键角为60°
参考答案:CD
本题解析:
本题难度:简单
5、选择题 已知结构为正四面体型的离子E和直线型离子G反应,生成三角锥分子L和V形分子M(组成E、G、L、M微粒的元素原子序数均小于10),反应过程用下图表示,则下列判断错误的是?(?)
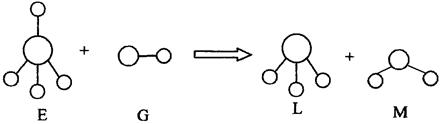
A.E、G、L、M都是10e 微粒
微粒
B.L、M都是极性分子
C.L能使紫色石蕊试液变蓝色
D.E离子中,质子数一定大于中子数
参考答案:D
本题解析:本题由05年上海高考试题改编而来。首先由信息“组成E、G、L、M微粒的元素原子序数均小于10”和“正四面体型的离子E和直线型离子G反应生成两种分子”,可以判定此反应是:NH4+ + OH- ="=" NH3 + H2O,进而推出A、B、C都正确。D选项考查了同位素的有关知识,当这里氢元素是氚时,则质子数小于中子数。
本题难度:一般