微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 99℃时KW=1x10-12,该温度下在某物质的溶液中,由水电离出的H+浓度为1×10-a mol/L,下列说法不正确的是?( )
A.a<6时,水的电离受到促进
B.a>6时,水的电离受到抑制
C.a<6时,溶液的pH可能为a
D.a>6时,溶液的pH一定为12-a
参考答案:D
本题解析:略
本题难度:简单
2、简答题 (12分)浸出-萃取-电积法已成为铜湿法冶金的主要工艺过程。以黄铜铜为原料,采用电积法生产阴极铜生产线,主要生产工艺为:
黄铜铜→硫酸浸出→过滤→萃取→反萃→电积→阴极铜。
(1)浸出是用浸矿剂将铜矿石中的铜进入溶液中。据报道,有一种叫Thibacillus Ferroxidans的细菌在氧气存在下,酸性溶液中,将黄铜矿氧化成硫酸盐,写出用硫酸浸出黄铜矿发生反应的离子方程式:?。
(2)萃取是利用特效铜萃取剂在含铜、铁及其碱性金属离子的低浓度含杂浸出液中有选择性地使铜离子萃入有机相,将铜离子与其它金属离子有效地分离,并通过反萃取使低浓度铜离子的原液富集成适宜电积要求的硫酸铜溶液。萃取过程的化学平衡为:2RH+Cu2+ R2Cu+2H+。则萃取和反萃取进行的程度受?和?的影响。
R2Cu+2H+。则萃取和反萃取进行的程度受?和?的影响。
(3)电积是将萃取富集后的铜溶液电解沉积出阴极铜。右图为用惰性阳极电积阴极铜的装置图:

①在图示方框中标出电源的正负极。
②写出电积阴极铜的总反应?。
(4)金属铜长期露置于空气中容易生锈,铜锈的主要成分为?,请利用电化学原理画出防止铜腐蚀的装置图。
参考答案:⑴4CuFeS2+4H++17O2=4Cu2++4Fe3++8SO42+2H2O(2分)
⑵浸出液的pH(1分) ?反萃取剂的酸度(1分)
⑶① (2分)
(2分)
②2CuSO4+2H2O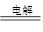 2Cu+O2↑+2H2SO4(2分)?⑷Cu2(OH)2CO3(2分)
2Cu+O2↑+2H2SO4(2分)?⑷Cu2(OH)2CO3(2分)
 (2分)
(2分)
本题解析:⑴根据提供信息,该反应为黄铜矿、氧气、硫酸发生氧化还原反应,生成硫酸铜、硫酸铁和水。
⑵根据萃取和反萃取的化学平衡,进行的程度受萃取液的pH和反萃取剂的酸度的影响。
⑶电解硫酸铜溶液的反应为2CuSO4+2H2O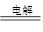 2Cu+O2↑+2H2SO4,阳极产生氧气,与电源正极相连,阴极析出铜,与电源负极相连。
2Cu+O2↑+2H2SO4,阳极产生氧气,与电源正极相连,阴极析出铜,与电源负极相连。
⑶铜锈的主要成分为Cu2(OH)2CO3,要保护铜不受腐蚀,装入可以让铜作原电池的正极或电解池的阴极,即可分别利用牺牲阳极的阴极保护法和外接电源的阴极保护法防止金属铜腐蚀。
本题难度:一般
3、选择题 将右图所示实验装置的K闭合,下列判断正确的是
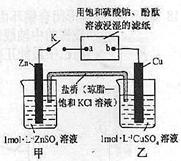
A.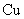 电极上发生还原反应
电极上发生还原反应
B.电子沿Zn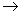 a
a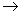 b
b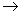 Cu路径流动
Cu路径流动
C.片刻后甲池中c(SO42—)增大
D.片刻后可观察到滤纸b点变红色
参考答案:A
本题解析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。铜比锌活泼,所以锌是负极,失去电子,发生氧化反应。铜是正极,溶液中的铜离子得到电子,发生还原反应,A正确;电子沿Zn a,a
a,a b是在溶液中离子导电,然后电子再从b
b是在溶液中离子导电,然后电子再从b Cu路径流动,B不正确;片刻后甲池中c(SO42—)不变,C不正确;b点和电源的正极相连,是阳极,溶液中的OH-放电,附近溶液显酸性,不变色,D不正确,答案选A。
Cu路径流动,B不正确;片刻后甲池中c(SO42—)不变,C不正确;b点和电源的正极相连,是阳极,溶液中的OH-放电,附近溶液显酸性,不变色,D不正确,答案选A。
点评:该题是高考中的常见考点和题型,属于中等难度试题的考查,试题综合性强,在对学生基础知识巩固和训练的同时,侧重对学生能力的培养,旨在考查学生灵活运用电化学原理解决实际问题的能力。该题的关键是明确原电池和电解的工作原理,特别是离子的放电顺序,并能结合题意灵活运用即可。
本题难度:一般
4、填空题 (8分)铅蓄电池是最常见的二次电池,它是由两组平行排列的栅状铅合金极板作为主架,正极板上覆盖PbO2,负极板上覆盖Pb,电解质是硫酸。电池总反应式为:
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题:
(1)放电时:正极的电极反应式是__________________________;电解液中H2SO4的浓度将变____________;当外电路通过1 mol电子时,理论上负极板的质量增加______________g。
(2)在完全放电耗尽PbO2和Pb时,若按下图连接,电解一段时间后,则在A电极上生成____________、在B电极上生成____________,此时铅蓄电池的正负极的极性将____?_____。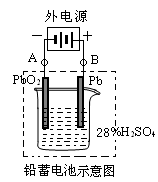
参考答案:(1)PbO2 + 4H+ + SO42- + 2e-= PbSO4 + 2H2O (2分)小(1分)? 48(2分)
(2)Pb? PbO2?对换(各1分)
本题解析:(1)放电相当于原电池,正极是得到电子的。所以根据总的方程式可知,正极反应式是PbO2 + 4H+ + SO42- + 2e-= PbSO4 + 2H2O。根据总反应的方程式可知,放电是消耗硫酸的,因此硫酸的浓度是降低的;负极方程式是Pb+ SO42-- 2e-= PbSO4,所以外电路通过1 mol电子时,理论上负极板的质量增加0.5mol×96g/mol=48g。
(2)根据装置图可知,铅和电源的正极相连,作阳极,失去电子。而二氧化铅和电源的负极相连,作阴极,得到电子。所以A电极上生铅,B电极生成二氧化铅,因此此时铅蓄电池的正负极的极性将对换。
本题难度:一般
5、填空题 (每空2分,共12分)
(Ⅰ)钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀。在空气酸度不大的环境中,其负极是?,负极反应式为?;正极是?,正极反应式为?。受空气的影响还会发生相应的颜色变化,其相应的化学方程式为?。
(Ⅱ)下列各情况,在其中Fe片腐蚀由快到慢的顺序是(用序号表示)?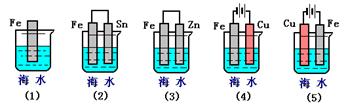
参考答案:(每空2分,共12分)(Ⅰ)铁? Fe-2 e- = Fe2+?;碳
O2 +4 e- + 2H2O =" 4" OH-?4Fe(OH)2+O2+2H2O=4Fe(OH)3?(Ⅱ) (5)(2)(1)(3)(4)
本题解析:(1)考查钢铁的电化学腐蚀。钢铁发生电化学腐蚀时,铁是负极,失去电子,电极反应式是Fe-2 e- = Fe2+;如果在空气酸度不大的环境中,发生的是吸氧腐蚀,正极反应式是O2 +4 e- + 2H2O =" 4" OH- ;生成的亚铁离子和OH-离子结合生成氢氧化亚铁,氢氧化亚铁不稳定,极易被氧气氧化生成红褐色氢氧化铁,反应的方程式是
4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(Ⅱ)装置(1)是铁的化学腐蚀。装置(2)、(3)中都是原电池,由于金属性强弱顺序是锌、铁、锡,所以在装置(2)中铁是负极,失去电子,而在装置(3)中铁是正极被保护;装置(4)、(5)中都是电解池,其中装置(4)中铁是阴极,被保护,装置(5)中铁是阳极,被腐蚀,所以正确的答案是(5)(2)(1)(3)(4)?。
本题难度:一般