|
高中化学知识点讲解《弱电解质电离平衡》考点强化练习(2017年押题版)(八)
2017-03-05 14:11:00
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 25 ℃时有三瓶溶液:pH=3的盐酸、pH=3的醋酸溶液和pH=11的氢氧化钠溶液,下列说法正确的是
A.中和等体积的pH=11的氢氧化钠溶液,所需pH=3的醋酸溶液的体积大于pH=3的盐酸的体积
B.往上述盐酸、醋酸溶液中分别加入少量相同的锌粒,盐酸中的锌粒先反应完全
C.将上述醋酸溶液、氢氧化钠溶液混合得到pH=7的溶液,该溶液中c(Na+)大于c(CH3COO-)
D.25℃时pH=3的盐酸、pH=3的醋酸溶液中水电离出的c(H+)均为10-11 mol·L-1
|
参考答案:D
本题解析:pH=3的盐酸、pH=3的醋酸溶液和pH=11的氢氧化钠溶液中c(CH3COOH)>c(HCl)=c(NaOH)=0.001mol/L,
A.中和等体积pH=11的氢氧化钠溶液,因为c(CH3COOH)>c(HCl),所以所需pH=3醋酸溶液的体积小于pH=3盐酸的体积,A错误;B.等体积pH=3盐酸和pH=3醋酸溶液中分别加入少量相同的锌粒,醋酸中存在电离平衡,随着反应的进行,醋酸溶液中氢离子浓度大于盐酸,所以醋酸中锌粒先反应完,B错误;C.溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得 c(Na+)+c(H+)=c(OH-)+c(CH3COO-),所以c(Na+)=c(CH3COO-),C错误;D.相同温度下,pH=3的盐酸、pH=3的醋酸溶液中氢离子浓度相同,水的离子积常数相同,所以溶液中氢氧根离子浓度相同,所以水电离出的c(H+)均为10-11mol/L,D正确;选D。
考点:考查弱电解质的电离与溶液的PH值。
本题难度:一般
2、填空题 (12分) 常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
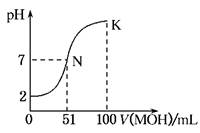
(1)由图中信息可知HA为________酸(填“强”或“弱”),理由是____________(2分)
(2)常温下一定浓度的MA稀溶液的pH=a,则a________7(填“>”、“<”或“=”),用离子方程式表示其原因为__________________________;,此时,溶液中由 水电离出的c(OH-)=________。(4分)
(3)请写出K点所对应的溶液中离子浓度的大小关系:__________?(2分)
(4)K点对应的溶液中,c(M+)+c(MOH)________2c(A-)(填“>”、“<”或“=”);若此时溶液中,pH=10,则c(MOH)+c(OH-)=________mol·L-1。(4分)
参考答案:(1)强 0.01 mol·L-1HA的pH为2,说明HA完全电离
(2)< M++H2O?MOH+H+,1×10-amol·L-1,(3)c(M+)>c(A-)>c(OH-)>c(H+),(4)= 0.005
本题解析:此题为关于溶解度曲线的题目,首先要看清曲线:起点(强酸弱酸、强碱弱碱),曲线平滑、滴定终点、pH=7的点等等。(1)因为浓度0.01mol/L,pH=2,故该酸为一元强酸;(2)V=50ml滴定终点时,pH<7,为强酸弱碱盐,水解为酸性。故该碱为弱碱,M++H2O MOH+H+,促进水的电离c(OH-)=1×10-amol·L-1;(3)K点为MA和MOH的混合溶液,故离子浓度大小关系为c(M+)>c(A-)>c(OH-)>c(H+),(4)根据物料守恒,c(A-)+c(HA)=0.1L×0.01mol/L=0.001mol,c(M+)+c(MOH)= 0.1L×0.02mol/L=0.002mol;故有c(M+)+c(MOH)=2[c(A-)+c(HA)]> 2c(A-) MOH+H+,促进水的电离c(OH-)=1×10-amol·L-1;(3)K点为MA和MOH的混合溶液,故离子浓度大小关系为c(M+)>c(A-)>c(OH-)>c(H+),(4)根据物料守恒,c(A-)+c(HA)=0.1L×0.01mol/L=0.001mol,c(M+)+c(MOH)= 0.1L×0.02mol/L=0.002mol;故有c(M+)+c(MOH)=2[c(A-)+c(HA)]> 2c(A-)
本题难度:一般
3、填空题 在温度T1和T2下,X2(g)和 H2反应生成HX的平衡常数如下表:
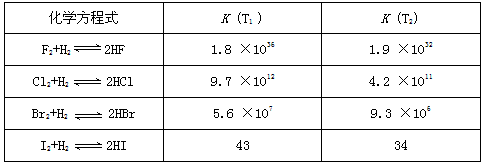
(1)仅依据K的变化,可以推断出:随着卤素原子核电荷数的增加,_______(选填字母)
a. 在相同条件下,X2的平衡转化率逐渐降低
b. X2与H2反应的剧烈程度逐渐减弱
c. HX的稳定性逐渐减弱
d. HX的还原性逐渐
(2)在容积为3L的密闭容器中,由I2(g)和H2(g)合成HI(g),在其他条件不变的情况下,研究温度对反应的影响,HI的物质的量的变化情况如下图所示。
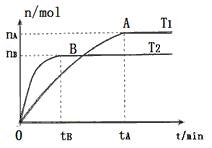
①温度为T1时,在0~tAmin内,H2的消耗速率v (H2)=__________
②分析上图所示图像,下列说法正确的是________(填序号)
a.温度为T2,容器内气体密度不变时,反应到达B点所示状态
b.平衡状态从A点移动到B点,n(HI)/n(H2)增大
c.该反应为放热反应
(3)加水稀释0.1mol·L-1的HF溶液,下列各量中增大的是________(填序号)
a. c(H+)
b. Ka(HF)
c. c(F-)/c(H+)
d. c(H+) / c(HF)
(4)在0.1mol·L-1HCl溶液中加入过量AgNO3溶液,产生白色沉淀,再滴加KI溶液,出现黄色沉淀,试写出有关的离子方程式____________ 、_____________ 。
参考答案:(1)ac
(2)2nA/3tA mol·L-1·min-1; c
(3)d
(4)Ag++Cl-==AgCl↓ ;AgCl(s)+I-(aq)=AgI(s)+Cl-(aq)
本题解析:
本题难度:一般
4、选择题 下列有关电解质的电离和水解说法正确的是(?)
A.在25℃时,任何水溶液中Kw=1×10-14。
B.在NaHSO4溶液中,c(H+)=c(OH-)+c(SO42-)
C.在pH=2的盐酸酸化的FeCl3溶液,稀释至10倍,则溶液pH=3
D.0.1mol/L醋酸溶液中加入冰醋酸,平衡正向移动,醋酸的电离程度增大
参考答案:B
本题解析:A.在25℃时,在任何物质的稀的水溶液中存在着Kw=1×10-14。如果浓度较大,就不符合。错误。B.在溶液中H+由H2O和NaHSO4共同电离产生。NaHSO4=Na++H++ SO42-.;H2O H++OH-.故c(H+)=c(OH-)+c(SO42-)。正确。C.在pH=2的盐酸酸化的FeCl3溶液,若稀释至10倍,若盐水解的程度不变则溶液pH=3,但稀释使FeCl3的水解程度增大故溶液2<pH<3.错误。D.0.1mol/L醋酸溶液中加入冰醋酸,平衡正向移动,但是增加的醋酸比平衡移动减少的醋酸要多,该醋酸的电离程度反而减小。错误。 H++OH-.故c(H+)=c(OH-)+c(SO42-)。正确。C.在pH=2的盐酸酸化的FeCl3溶液,若稀释至10倍,若盐水解的程度不变则溶液pH=3,但稀释使FeCl3的水解程度增大故溶液2<pH<3.错误。D.0.1mol/L醋酸溶液中加入冰醋酸,平衡正向移动,但是增加的醋酸比平衡移动减少的醋酸要多,该醋酸的电离程度反而减小。错误。
本题难度:一般
5、选择题 下列各组物质全部是弱电解质的是
A.H2O、 NH3·H2O、 H3PO4、 HF
B.Cu(OH)2、CH3COOH、C2H5OH、CH3COONa
C.H2SO3、Ba(OH)2、 BaSO4 AgCl
D.H2SiO3、H2S、CO2
|