| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学试题《盐类水解的原理》在线测试(2017年最新版)(八)
参考答案:(1)A-+H2O 本题解析:(1)若HA是强酸,则恰好生成强酸强碱盐,溶液显中性,而溶液PH=8,说明溶液显碱性,生成的是强碱弱酸盐,水解显碱性。(2)盐类水解促进水的电离,酸、碱都能抑制水的电离,所以混合溶液中由水电离出的c(H+)>0.1 mol·L-1,NaOH溶液中由水电离出的c(H+)。(3)本小题考查的是电荷守恒问题和有关pH的计算,c(Na+)+c(H+)=c(OH-)+ c(A),所以c(Na+)-c(A)=c(OH)-c(H+)=1×10-6mol·L-1-1×10-8mol·L-1。根据质子守恒A-+H2O 本题难度:困难 3、选择题 下列液体均处于25°C,有关叙述正确的是 |
参考答案:C
本题解析:A、在同浓度的CaCl2和NaCl溶液中,铝离子浓度较大,对氯化银的溶解起到了抑制作用,所以AgCl在同浓度的CaCl2和NaCl溶液中的溶解度不相同,错误;B、pH<7的溶液有可能是酸,强酸弱碱盐或者强酸的酸式盐,错误;C、pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中的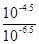 =100倍,正确;D、pH=5.6的CH3COOH与CH3COONa混合溶液中,c(CH3COO-)>c(Na+),错误;故本题选择C。
=100倍,正确;D、pH=5.6的CH3COOH与CH3COONa混合溶液中,c(CH3COO-)>c(Na+),错误;故本题选择C。
考点:难溶电解质的溶解平衡,pH的基本计算,离子浓度的比较
本题难度:一般
4、填空题 (1)已知在常温下测得浓度均为0.1 mol/L的下列5种溶液的pH: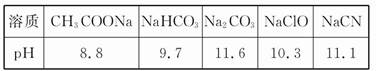
根据上述信息判断,浓度均为0.05 mol/L的下列5种物质的溶液中,pH最小的是 (填编号);其pH为 (填数值);pH最大的是 (填编号)。
①CH3COOH ②HCN ③HClO ④H2SO4 ⑤HClO4
(2)下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液。
②在侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体。
③蒸发KCl和NaNO3混合溶液,首先析出NaCl晶体。
根据上述反应,总结出复分解反应发生的一个规律: ;
将KI溶液和AgCl固体混合搅拌,会观察到的现象是 ,
请写出反应的离子方程式: 。
参考答案:(1)④ 1 ②
本题解析:(1)5种溶液中H2SO4、HClO4为强酸,相同浓度时H2SO4的pH最小,pH=-lg(2×0.05)=1。pH最大的即酸性最弱的,根据“酸越弱越水解”并结合题干信息,相同浓度时NaCN碱性强,则对应的HCN的酸性最弱,pH最大。因CO32-对应酸为HCO3-,此处易将Na2CO3溶液碱性更强误认为H2CO3酸性最弱。
(2)从题给3个转化可以看出,反应之所以能够发生,是因为生成溶解度更小的物质。因AgI的溶解度小于AgCl,白色沉淀AgCl能够转化为黄色沉淀AgI
本题难度:一般
5、填空题 (6分)在25℃时,将酸HA与碱MOH等体积混合.
(1)若0.01mol/L的强酸HA与0.01mol/L强碱MOH混合,则所得溶液显 (填“酸性”、“中性”或“碱性”,下同)该反应的离子方程式为 。
(2)若PH=3的强酸HA与PH=11的弱碱MOH混合,则所得溶液显 ,
理由是 。
(3)若0.01mol/L的强酸HA与0.01mol/L弱碱MOH混合,则所得溶液显 ,解释这一现象的离子方程式是 。
参考答案:(1)中性 H++OH-=H2O(2)碱性 酸HA与碱MOH中和后,碱过量,还会电离出OH-
(3)酸性 M++H2O MOH+H+
MOH+H+
本题解析:(1)等浓度的一元强酸与一元强碱等体积混合,恰好反应生成强酸强碱盐,该盐溶液显中性,该反应的离子方程式为H++OH-=H2O;
(2)强酸电离出的H+浓度等于弱碱电离出的OH-,所以弱碱的浓度大于强酸,则等体积混合后溶液为强酸弱碱盐和弱碱的混合溶液,显碱性,原因是酸HA与碱MOH中和后,碱过量,还会电离出OH-;
(3)同浓度的一元强酸与一元弱碱等体积混合,恰好反应生成强酸弱碱盐,溶液呈酸性,出现这一现象的离子方程式M++H2O MOH+H+。
MOH+H+。
考点:考查溶液的酸碱性,溶液的PH,酸碱中和反应等知识。
本题难度:一般
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:高考化学知识点归纳《水的电离平.. | ||