微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 下图是实验室制取乙酸乙酯的装置。
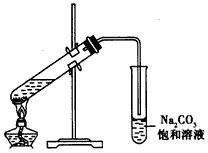
(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合溶液的方法:将_____________________,并轻轻地振荡试管,使之混合均匀。
(2)装置中通蒸气的导管要插在饱和Na2CO3溶液的液面上,不能插入溶液中,目的是防止Na2CO3溶液的倒吸,造成倒吸的原因是________________________。
(3)浓硫酸的作用是:①________________________;②________________________。
(4)饱和N2CO3溶液的作用是____________________________。
(5)实验中生成的乙酸乙酯,其密度比水_______(填“大” 或“小”),有_______气味。
(6)若实验中温度过高,使反应温度达到140℃左右时,副反应的主要有机产物有________________(填物质名称)。
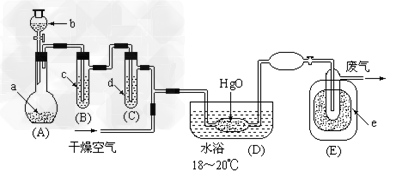
2、推断题 氧化二氯是黄棕色具有强烈刺激性的气体。它的熔点-116℃,沸点3.8℃.氧化二氯不稳定,接触一般有机物易爆炸;它易溶于水(1∶100)同时反应生成次氯酸溶液.制备出之后要冷却为固态才便于操作和贮存。制取少量氧化二氯,是用干燥的氧化汞与氯气反应(还生成HgO·HgCl2)。装置如图,铁架台和夹持仪器已略去。 ? ?
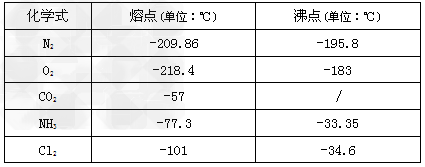
部分物质的有关物理数据如下:
试回答:?
(1)A中盛有深色固体试剂a是__________,分液漏斗中b试剂是?____________?。
(2)B中盛有液体c是__________,C中的液体d是___________?。
(3)D中发生化学反应的化学方程式是?_____________?。
(4)E中的保温瓶中盛有致冷剂,它应是___________?(在干冰、冰水、液态空气、液氨中选择)。在E的内管得到的Cl2O中可能含有的主要杂质是____________。
(5)装置A、B、C间的连接方式与D、E间的连接方式有明显的区别,这区别是__________,用这些不同的连接方式的主要理由是______________?。
3、实验题 在浓CaCl2溶液中通入氨气和CO2,再经过滤可以制得纳米碳酸钙。
(1)除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是_____________。
(2)若不通入氨气能否生成CaCO3?________。
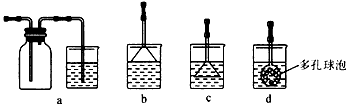
(3)若实验过程中有氨气逸出,应选用下列_________装置回收(填代号)。
(4)根据上述反应原理,向饱和食盐水中通入氨气和CO2能得到NaHCO3,若食盐水中含有KCl杂质,则检验得到的NaHCO3中是否混有钾盐的方法是____________
4、实验题 二苯基乙二酮常用作医药中间体及紫外线固化剂,可由二苯基羟乙酮氧化制得,反应的化学方程式及装置图(部分装置省略)如下
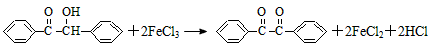
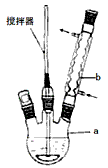
在反应装置中,加入原料及溶剂,搅拌下加热回流。反应结束后加热煮沸,冷却后即有二苯基乙二酮粗产品析出,用70%乙醇水溶液重结晶提纯。重结晶过程:加热溶解→活性炭脱色→趁热过滤→冷却结晶→抽滤→洗涤→干燥请回答下列问题:
(1)写出装置图中玻璃仪器的名称:a___________,b____________。
(2)趁热过滤后,滤液冷却结晶。一般情况下,下列哪些因素有利于得到较大的晶体:____。
A.缓慢冷却溶液 B.溶液浓度较高 C.溶质溶解度较小 D.缓慢蒸发溶剂
如果溶液中发生过饱和现象,可采用__________等方法促进晶体析出。
(3)抽滤所用的滤纸应略_______(填“大于”或“小于”)布氏漏斗内径,将全部小孔盖住。烧杯中的二苯基乙二酮晶体转入布氏漏斗时,杯壁上往往还粘有少量晶体,需选用液体将杯壁上的晶体冲洗下来后转入布氏漏斗,下列液体最合适的是________。
A.无水乙醇 B.饱和NaCl溶液 C.70%乙醇水溶液 D.滤液
(4)上述重结晶过程中的哪一步操作除去了不溶性杂质:___________。
(5)某同学采用薄层色谱(原理和操作与纸层析类同)跟踪反应进程,分别在反应开始、回流15min、30min、45min和60min时,用毛细管取样、点样、薄层色谱展开后的斑点如图所示。该实验条件下比较合 适的回流时间是________。
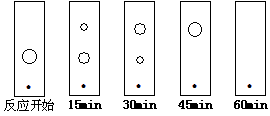
A.15min B.30min C.45min D.60min
5、实验题 现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验。
I、甲同学向1 mol·L-1氯化铁溶液中加入少量的NaOH溶液;
II、乙同学直接加热饱和FeCl3溶液;
III、丙同学向25ml沸水中逐滴加入1~2mL FeCl3饱和溶液,继续煮沸至溶液呈红褐色,停止加热。
根据你的理论和实践试回答下列问题:
(1)其中操作最可能成功的同学是_____;他的操作中涉及到的化学反应方程式为_______________
(2)设计最简单的办法确证有Fe(OH)3胶体生成,其操作是:__________________若现象是:________________则一定有Fe(OH)3胶体生成。
(3)丁同学利用所制得的Fe(OH)3胶体进行下列实验:
①将其装入U形管内,用石墨作电极,接通直流电,通电一段时间后发现阴极附近的颜色逐渐变深,这表明_________________________
②向其中加入硫酸铝,产生的现象是_________________________