|
高考化学知识点归纳《物质制备实验方案的设计》答题技巧(2017年最新版)(四)
2017-03-05 14:16:35
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 l-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为ll5~l25℃,反应装置如图.下列对该实验的描述错误的是( )
A.不能用水浴加热
B.长玻璃管起冷凝回流作用
C.提纯乙酸丁酯需要经过水、氢氧化钠溶液洗涤
D.加入过量乙酸可以提高1-丁醇的转化率
| 
参考答案:C
本题解析:
本题难度:简单
2、实验题 一水硫酸四氨合铜(Ⅱ)的化学式为[ Cu( NH3)4]SO4·H2O,是一种重要的染料及农药中间体。某学习小组在实验室以氧化铜为主要原料合成该物质,设计的合成路线为:
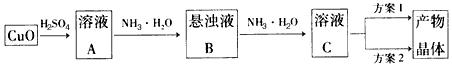
相关信息如下: ①[Cu( NH3)4]SO4·H2O在溶液中存在以下电离(解离)过程:
[ Cu(NH3)4]SO4·H2O=[ Cu( NH3)4]2++SO42-+H2O
[Cu(NH3)4]2+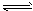 Cu2++4NH3②(NH4)·SO4在水中可溶,在乙醇中难溶。 Cu2++4NH3②(NH4)·SO4在水中可溶,在乙醇中难溶。
③[ Cu( NH3)4]SO4·H2O在乙醇一水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图如下
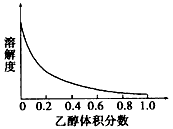
请根据相关信息回答下列问题:
?方案l的实验步骤为: a.加热蒸发,b.冷却结晶,c.抽滤,d.洗涤,e.干燥
?(1)①步骤c的抽滤装置如下图所示,该装置中的错误之处是____;抽滤完毕或中途需停止抽滤时,应先______,然后________。
②该方案存在明显缺陷,因为得到的产物晶体中往往含有____杂质,产生该杂质可能的原因是______ 。
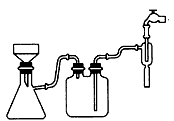
方案2的实验步骤为:
(2)a向溶液C中加入适量______,b_______,c.洗涤,d.干燥。
①请在上述空格内填写合适的试剂或操作名称。
(3) ②下列选项中,最适合作为步骤c的洗涤液是____。
A.乙醇 B.蒸馏水 C.乙醇和水的混合液 D.饱和硫酸钠溶液
③步骤d不宜采用加热干燥的方法,可能的原因是__________。
参考答案:(1)①布氏漏斗的颈口斜面未朝向抽滤瓶的支管口;断开连接安全瓶与抽气装置间的橡皮管;关闭抽气装置中的水龙头 ②Cu( OH)2或[Cu2(OH)2SO4];加热蒸发过程中NH3挥发,使反应 [Cu(NH3)4]2+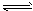 Cu2++4NH3平衡往右移动,且Cu2+水解 Cu2++4NH3平衡往右移动,且Cu2+水解
(2)①乙醇;抽滤(或减压过滤、吸滤)
(3)②C; ③加热易使[?Cu(?NH3)4]SO4·H2O分解(失H2O、失NH3)
本题解析:
本题难度:困难
3、实验题 某同学设计实验室利用铝土矿(主要成分Al2O3,还含有Fe2O3、SiO2等)制取氯化铝的方案,过程如下
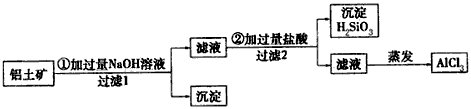
(1)用化学式表示过滤1得到的沉淀是______________。
(2)写出步骤②中发生反应的离子方程式:___________。
(3)蒸发AlCl3溶液提取AlCl3需要在HCl气氛中进行,理由是_________________________。
(4)实验证明,熔融的AlCl3不导电,推测其原因是:_________________________最新报道工业采用电解
AlCl3-NaCl熔盐制铝工艺,试写出该电解反应的化学方程式________________________ 。研究证实该熔盐体系中,铝元素以AlCl4-和Al2Cl7-离子的形式存在,则在此工艺中NaCl的作用是__________________
(5)铝是一种重要的金属,下列关于铝的叙述中不正确的是___________(填序号)。
A.铝元素在地壳中含量虽比铁高,但金属铝的使用较晚
B.铝热反应可用于冶炼金属,尤其可以冶炼一些难熔金属
C.铝燃烧时会放出大量的热,可以作为一种生活能源
D.镁和铝与氢氧化钠溶液能形成原电池,在镁电极表面有气体产生
E.用铝板和铂网做电极,以海水为电解质溶液可以制成海洋电池
参考答案:(1)Fe2O3
(2)OH-+H+=H2O、AlO2-+4H+=Al3++2H2O、SiO32-+2H+=H2SiO3↓
(3)AlCl3发生水解AlCl3+3H2O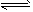 Al(OH)3+3HCl,蒸发时由于HCl挥发最终得不到无水AlCl3而是氢氧化铝(或氧化铝),若在HCl气氛中进行蒸发可以抑制AlCl3的水解 Al(OH)3+3HCl,蒸发时由于HCl挥发最终得不到无水AlCl3而是氢氧化铝(或氧化铝),若在HCl气氛中进行蒸发可以抑制AlCl3的水解
(4)AlCl3在熔融状态下不发生电离,没有产生自由移动的离子;2AlCl3 2Al+3Cl2↑;做溶剂,使铝元素在其中形成AlCl4-和Al2Cl7-(配离子) 2Al+3Cl2↑;做溶剂,使铝元素在其中形成AlCl4-和Al2Cl7-(配离子)
(5)C
本题解析:
本题难度:困难
4、实验题 某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是 一个放热反应)。
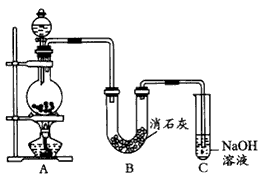
请回答下列问题:
(1)A为实验室制氯气的发生装置,反应原理为____。 某学生用12mol.L-1的浓盐酸l00mL和足量的MnO2反应制Cl2,实际得到的Cl2___6.72L(填“<”或 “>”或“=”)。
(2)漂白粉将在U形管中产生,其化学反应方程式是____。
(3)此实验所得漂白粉的有效成分偏低。该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应:
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是________。
②试判断另一个副反应是________,为避免此副反应的发生,可将装置作何改进______。
(4)C装置的作用是________。
参考答案:(1)MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O ;< MnCl2+Cl2↑+2H2O ;<
(2)2Cl2 +2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
(3)①冷却B装置(或将B装置放在冷水浴中);
②氯气中含有HCl,会与氢氧化钙反应[2HCl+Ca(OH)2=CaCl2+2H2O];
在A与B 之间连接一个装有饱和氯化钠溶液的洗气瓶
(4)吸收未反应完的氯气,防止污染空气
本题解析:
本题难度:一般
5、实验题 某化学活动小组设计以下装置进行不同的实验。其中a为用于鼓入空气的气囊,b为螺旋状铜丝,c中盛有冰水。

(1)若用A装置做乙醇与乙酸的酯化反应实验,则还需连接的装置是_________(填序号),该装置中应加入试剂_________。从实验安全角度考虑,A装置试管中除加入反应液外,还需加入的固体物质是__________________。
(2)该小组同学欲做乙醇氧化成乙醛的实验,则应选用的装置是_________(填序号),再用制得的乙醛溶液进行银镜反应,正确的操作顺序是_________(填序号)。
①向试管中滴入3滴乙醛溶液
②一边振荡一边滴入2%的稀氨水,直至最初产生的沉淀恰好溶解为止
③振荡后放入热水中,水浴加热
④在洁净的试管中加入1mL2%的AgNO3溶液
参考答案:(1)D;饱和Na2CO3溶液;碎瓷片
(2)ABC;④②①③
本题解析:
本题难度:一般
| 