微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在0.1 mol/L的NaHS溶液中有关微粒浓度的关系正确的是
A.c(Na+)>c(HS-)>c(S2-)>c(H+)>c(OH-)
B.c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)
C.c(Na+)=c(HS-)+c(S2-)+c(OH-)
D.c(Na+)=c(HS-)+c(S2-)+c(H2S)
参考答案:D
本题解析:
本题难度:困难
2、选择题 下列有关问题,与盐的水解有关的是?(?)
①NH4Cl与ZnCl2溶液可做焊接金属中的除锈剂
②用NaHCO3与Al2(SO4)3两种溶液可做泡沫灭火剂
③草木灰与铵态氮肥不能混合施用
④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞
⑤加热蒸干AlCl3溶液得到Al(OH)3固体
⑥用热的Na2CO3溶液去污
⑦使用明矾净水
⑧贮存FeCl3溶液滴加几滴盐酸
A.①②③⑤
B.②③④⑥⑧
C.①④⑤⑦⑧
D.全部
参考答案:D
本题解析:NH4Cl与ZnCl2均水解显酸性,所以可做焊接金属中的除锈剂。NaHCO3水解显碱性,Al2(SO4)3水解显酸性,水解相互促进,生成氢氧化铝和CO2。草木灰水解显碱性,铵态氮肥水解显酸性,混合施用会降低肥效。碳酸钠水解显碱性,容易在瓶口周围产生硅酸钠,而不易打开瓶塞。铝离子水解,生成氢氧化铝和氯化氢,水解吸热,加热促进水解。同时氯化氢的挥发,进一步促进水解,所以最终得到的是氢氧化铝。碱性越强,去污能力就越强。明矾溶于水,铝离子水解,生成氢氧化铝胶体,悬浮悬浮物,从而净水。FeCl3水解显酸性,加入盐酸,抑制水解。所以答案是D。
本题难度:一般
3、填空题 (12分) .
(1)稀释0.1 mol·L-1氨水时,随着水量的增加而减小的是 (填写序号)。
① ②
②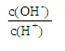 ③c(H+)和c(OH-)的乘积 ④OH-的物质的量
③c(H+)和c(OH-)的乘积 ④OH-的物质的量
(2)pH相同的等体积的A、B两份溶液(A为盐酸,B为醋酸)分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是________(填写序号)。
①反应所需的时间B>A
②开始反应时的速率A>B
③参加反应的锌粉物质的量A=B
④反应过程中的平均速率B>A
⑤A溶液里有锌粉剩余
⑥B溶液里有锌粉剩余
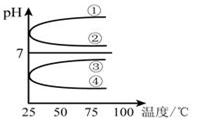
(3)将等体积、等物质的量浓度的氨水和盐酸混合后,升高温度(溶质不会分解)溶液的pH随温度变化是图中的_________曲线(填写序号) 。
(4)室温下,向0.01mol·L-1NH4HSO4溶液中滴加0.01mol·L-1 NaOH溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为______________ 。
(5)25℃,将a mol·L-1的氨水与0.0lmol·L-l的盐酸等体积混合,反应达平衡时溶液中c(NH4+)=c(Cl-)。则溶液显____ 性(填“酸’’、“碱”或“中”);用含a的代数式表示NH3·H2O在25℃时的电离平衡常数Kb= 。
参考答案:(1)①② ; (2)③④ ⑤; (3)④ ;(4)c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) ;(5)中 ;
本题解析:(1))稀释0.1mol·L-1氨水时 ,①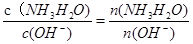 ,平衡向电离方向移动,电离出的n(OH-)增大,比值减小;②加水稀释,虽然平衡向电离方向移动,但c(OH-)浓度减小,根据才(OH-)c(H+)乘积是定值,故氢离子浓度增大,二者比值减小;③c(H+)和c(OH-)的乘积是定值,温度不变,乘积不变;④氢氧根离子的物质的量增大,故答案选①②;(2)等pH、等体积的两份溶液A(HCl)和E(CH3COOH),醋酸是弱电解质存在电离平衡,所以醋酸溶液浓度大于盐酸难度,即醋酸的反应速率快,所用时间短,①、②错误;④正确;生成的氢气的物质的量相等,说明消耗锌粉的量相等,③正确;分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出的氢气的质量相同,只有强酸中剩余锌,⑤正确;答案为③④⑤;(3)醋酸和氨水恰好反应生成氯化铵,水解显酸性,水解反应是吸热的,故升高温度,促进水解平衡向正反应方向移动,故pH降低,答案为④;(4)常温下,向0.01mol/L C(NH4HSO4)溶液中滴加0.01mol/L D(NaOH)溶液至中性,NH4HSO4中滴入NaOH溶液,NaOH首先与NH4HSO4电离出的H+作用,因为H+结合OH-的能力比NH4+结合OH-的能量强(原因是产物H2O比NH3?H2O更难电离).当加入等摩尔的NaOH时,正好将H+中和,此时c(Na+)=c(SO42-),但此时溶液中还有NH4+,NH4+水解使溶液呈酸性,因此要使溶液呈中性,则还需继续滴入NaOH,当然到中性时c(OH-)=c(H+),c(Na+)>c(SO42-)>c(NH4+);故答案为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).;(5)由电荷守恒得,c(NH4+)=c(Cl-),则c(OH-)=c(H+),溶液显中性。氨水的电离常数为Kb=
,平衡向电离方向移动,电离出的n(OH-)增大,比值减小;②加水稀释,虽然平衡向电离方向移动,但c(OH-)浓度减小,根据才(OH-)c(H+)乘积是定值,故氢离子浓度增大,二者比值减小;③c(H+)和c(OH-)的乘积是定值,温度不变,乘积不变;④氢氧根离子的物质的量增大,故答案选①②;(2)等pH、等体积的两份溶液A(HCl)和E(CH3COOH),醋酸是弱电解质存在电离平衡,所以醋酸溶液浓度大于盐酸难度,即醋酸的反应速率快,所用时间短,①、②错误;④正确;生成的氢气的物质的量相等,说明消耗锌粉的量相等,③正确;分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出的氢气的质量相同,只有强酸中剩余锌,⑤正确;答案为③④⑤;(3)醋酸和氨水恰好反应生成氯化铵,水解显酸性,水解反应是吸热的,故升高温度,促进水解平衡向正反应方向移动,故pH降低,答案为④;(4)常温下,向0.01mol/L C(NH4HSO4)溶液中滴加0.01mol/L D(NaOH)溶液至中性,NH4HSO4中滴入NaOH溶液,NaOH首先与NH4HSO4电离出的H+作用,因为H+结合OH-的能力比NH4+结合OH-的能量强(原因是产物H2O比NH3?H2O更难电离).当加入等摩尔的NaOH时,正好将H+中和,此时c(Na+)=c(SO42-),但此时溶液中还有NH4+,NH4+水解使溶液呈酸性,因此要使溶液呈中性,则还需继续滴入NaOH,当然到中性时c(OH-)=c(H+),c(Na+)>c(SO42-)>c(NH4+);故答案为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).;(5)由电荷守恒得,c(NH4+)=c(Cl-),则c(OH-)=c(H+),溶液显中性。氨水的电离常数为Kb= =
= 答案为
答案为
考点:电荷守恒、盐类的水解
本题难度:困难
4、选择题 某种一元酸(HA)溶液中加入一定量的一种强碱(MOH)溶液后,恰好完全反应,则有关反应后溶液的判断中一定正确的是
A.[A-]≤[M+]
B.[A-]≥[M+]
C.若反应生成的MA不水解,则[A-]>[OH-]
D.若反应生成的MA水解,则[A-]<[OH-]
参考答案:AC
本题解析:本题中的一元酸可能是强酸或弱酸。若是HA为一元强酸与强碱完全中和时,[A-]=[M+],若HA为一元弱酸与强碱完全中和生成的MA为强碱弱酸盐,由于A-发生部分水解反应,[A-]<[M+],故A选项结论[A-]≤[M+]正确,而B选项不正确。若反应生成的MA不水解,即MA为强酸强碱盐,它电离出的[A-]一定大于由水电离出的[OH-]浓度,C选项也正确。
若是反应生成的MA能发生水解,说明HA必然是弱酸,MA为强碱弱酸盐,A-将发生水解:A-+H2O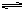 HA+OH-,多数情况[A-]>[OH-],D选项的结论正相反。
HA+OH-,多数情况[A-]>[OH-],D选项的结论正相反。
本题难度:困难
5、选择题 0.1mol/LNaOH溶液和0.1mol/LNH4Cl溶液等体积混合后,溶液中离子浓度大小顺序正确的是
A.c(Na+)>c(Cl-)>c(OH-)>c(H+)
B.c(Na+)=c(Cl-)>c(H+)>c(OH-)
C.c(Cl-)>c(Na+)>c(OH-)>c(H+)
D.c(Na+)=c(Cl-)>c(OH-)>c(H+)