微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积也相同时,反应中消耗的HCl和NaOH的物质的量之比为
[? ]
A.1:1
B.2:1
C.3:1
D.1:3
参考答案:C
本题解析:
本题难度:一般
2、填空题 海水中含有多种盐类物质,在一定温度下将海水不断浓缩,其间会不断有晶体析出,且海水的密度逐渐增大,下表为一定温度下不同密度的海水中几种盐类的含量(g/L)。

回答下列问题:
(1)在该温度下恒温蒸发海水时,海水的密度从1. 13 g/mL增大到1.21 g/mL时是否有硫酸钙析出?____。 (2)恒温下,当蒸发1m3密度为1. 22 g/mL的海水达到密度为1.26 g/mL时,析出MgSO4的质量为____ kg,析出NaCl的质量为____kg。
参考答案:(1)是(或“有”)
(2)0.03;8.33
本题解析:
本题难度:一般
3、计算题 在公交车站等车的时候你看到过这个广告吗?“又胃痛了?快吃达喜!”达喜是常用的中和胃酸的药物。达喜的化学成分是铝和镁的碱式碳酸盐。取该碱式碳酸盐2.20g,加入2.0?mol/L盐酸使其溶解,当加入盐酸30?mL时开始产生CO2,加入盐酸至35?mL时正好反应完全,在上述碱式盐溶于盐酸后的溶液中加入过量氢氧化钠,过滤,沉淀物进行干燥后重1.16g,试通过计算推测该碱式盐的化学式。(要有详细计算过程。)
参考答案:n(OH-):n(CO32-)=5:1;Mg2Al(OH)5CO3
本题解析:
本题难度:一般
4、计算题 化学实验小组将不同质量的镁铝合金与一定量的盐酸反应,通过测量反应过程中生成气体的体积,从而测定合金的组成和盐酸的浓度。实验操作:在甲、乙、丙三只反应器中,分别加入相同体积相同浓度的盐酸,然后分别慢慢加入组成相同、质量不同的镁铝合金粉末,测量产生的气体体积。实验数据:(气体体积已换算成标准状况下)
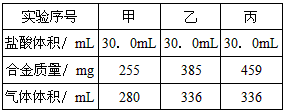
数据处理:(假设反应前后溶液体积不发生变化)
(1)判断甲组实验盐酸是否过量的方法是________________________;
(2)实验中所用盐酸的物质的量浓度为______________________;
(3)计算合金中Mg、Al的质量之比(写出计算过程)。
参考答案:(1)比较乙组数据,继续加入合金有气体产生,说明甲组盐酸过量
(2)1mol/L
(3)8:9
本题解析:
本题难度:一般
5、选择题 下列含有非极性键的离子化合物是
A.CaCl2
B.H2O2
C.Na2O2
D.CH4
参考答案:C
本题解析:考查化学键的判断。一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键。据此可知A是含有离子键的离子化合物,B是含有极性键和非极性键的共价化合物,C是含有离子键和非极性键的离子化合物,D是含有极性键的共价化合物。答案选C。
本题难度:一般