微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 合成氨工业中用铁触媒来催化N2和H2合成NH3.若将a?L?NH3通过灼热的装有铁触媒的硬质玻璃管后,气体体积变为b?L(气体体积均在同温同压下测定),则该b?L气体中的NH3体积分数是( )
A.
B.
C.
D.
参考答案:气体体积变化(b-a)L,则:
2NH3?催化剂?.△N2+3H2 体积增大△V
2?1?3? 1+3-2=2
(b-a)L? (b-a)L
所以混合气体中氨气的体积为aL-(b-a)L=(2a-b)L.
所以该b?L气体中的NH3体积分数是(2a-b)LbL=2a-bb.
故选:D.
本题解析:
本题难度:一般
2、填空题 (10分)已知铜在常温下能被HNO3溶解,反应方程式为:
3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O
(1)请将上述反应改成离子方程式
___________________________________________________________________
(2)上述反应中,氧化剂是 _____________,氧化产物是_____________。
(3)每2 molCu参加反应,转移的电子__________ 个,在反应的硝酸中没有参加氧化还原反应的硝酸占总硝酸的________________。
参考答案:(1)3Cu+8H++2NO ===3Cu2++2NO↑+4H2O
===3Cu2++2NO↑+4H2O
(2) HNO3Cu(NO3)2
(3)2.408×102475%
本题解析:(1)在3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O反应中,HNO3和Cu(NO3)2溶于水且电离,应写成离子的形式,离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;(2)在3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O反应中,HNO3中N元素的化合价由+5价降为+2价,被还原,作氧化剂,Cu元素的化合价由0价升高为+2价,作还原剂,被氧化,氧化产物为Cu(NO3)2;(3)每2 molCu参加反应,转移的电子2.408×1024个,反应中产生Cu(NO3)2的HNO3没有参加氧化还原反应,没有参加氧化还原反应的硝酸占参加反应的全部硝酸的75%。
考点:考查离子反应和氧化还原反应。
本题难度:一般
3、填空题 某混合溶液中可能含有的离子如下表所示:
可能大量含有的阳离子
| H+、Ag+、Mg2+、Al3+、NH4+、Fe3+
|
可能大量含有的阴离子
| Cl-、Br-、I-、CO32—、AlO2—
|
为探究其成分,进行了以下探究实验。
(1)探究一:
甲同学取一定量的混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如图所示。
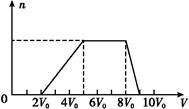
①该溶液中一定不存在的阳离子是 ,
一定不存在的阴离子是 ;含有的阳离子其对应物质的量浓度之比为 ;
②请写出沉淀减少过程中发生反应的离子方程式 。
(2)探究二:
乙同学检测到该溶液中含有大量的Cl-、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
Cl2的体积(标准状况)
| 11.2 L
| 22.4 L
| 28.0 L
|
n(Cl-)
| 2.5 mol
| 3.5 mol
| 4.0 mol
|
n(Br-)
| 3.0 mol
| 2.5 mol
| 2.0 mol
|
n(I-)
| x mol
| 0
| 0
|
①当起始至通入Cl2的体积为22.4 L时,溶液中发生反应总的离子方程式为 ;
②原溶液中Cl-、Br-、I-的物质的量浓度之比为 。
参考答案:(1)①Ag+、Mg2+、Fe3+ CO32—、AlO2—
c(H+)∶c(NH4+)∶c(Al3+)=2∶3∶1
②Al(OH)3+OH- AlO2—+2H2O
AlO2—+2H2O
(2)①4Cl2+2Br-+6I- 8Cl-+Br2+3I2
8Cl-+Br2+3I2
②1∶2∶1
本题解析:(1)向混合液中滴加NaOH溶液,一开始无沉淀生成,说明含有H+;沉淀量最大时继续滴加NaOH溶液,沉淀的量不变,说明含有NH4+,继续滴加,沉淀量减小直至消失,说明含有Al3+,则一定不含有CO32—、AlO2—(均可与Al3+发生水解反应),一定不含有Ag+、Mg2+、Fe3+(与OH-形成的沉淀不能溶于NaOH);由题目所给数据可得出H+、NH4+、Al3+的物质的量之比为:2∶3∶1;H+(0~2V0),NH4+(5V0~8V0),Al3+(8V0~9V0),沉淀减少段发生的反应为:Al(OH)3+OH- AlO2—+2H2O。
AlO2—+2H2O。
(2)当通入Cl2的体积为11.2 L时,溶液中I-还有剩余,即氯气只与I-反应:Cl2+2I- I2+2Cl-,生成1 mol Cl-,Cl-初始物质的量是(2 .5-1)mol="1.5" mol,Br-初始物质的量是3 mol;当通入Cl2 22.4 L时,3.0 mol-2.5 mol="0.5" mol 的Br-被氧化:Cl2+2Br-
I2+2Cl-,生成1 mol Cl-,Cl-初始物质的量是(2 .5-1)mol="1.5" mol,Br-初始物质的量是3 mol;当通入Cl2 22.4 L时,3.0 mol-2.5 mol="0.5" mol 的Br-被氧化:Cl2+2Br- Br2+2Cl-,消耗Cl2 0.25 mol,所以Cl2+2I-
Br2+2Cl-,消耗Cl2 0.25 mol,所以Cl2+2I- I2+2Cl-,该反应消耗的Cl2为:1 mol-0.25 mol="0.75" mol,因此原溶液中的I-为:0.75 mol×2="1.5" mol,故原溶液中的Cl-、Br-、I-的物质的量浓度之比为1.5∶3∶1.5=1∶2∶1。通入Cl2 22.4 L时,此时参加反应的Cl2、Br-、I-物质的量之比为:1 mol∶0.5 mol∶1.5 mol=2∶1∶3=4∶2∶6,故离子方程式为:4Cl2+2Br-+6I-
I2+2Cl-,该反应消耗的Cl2为:1 mol-0.25 mol="0.75" mol,因此原溶液中的I-为:0.75 mol×2="1.5" mol,故原溶液中的Cl-、Br-、I-的物质的量浓度之比为1.5∶3∶1.5=1∶2∶1。通入Cl2 22.4 L时,此时参加反应的Cl2、Br-、I-物质的量之比为:1 mol∶0.5 mol∶1.5 mol=2∶1∶3=4∶2∶6,故离子方程式为:4Cl2+2Br-+6I- 8Cl-+Br2+3I2。
8Cl-+Br2+3I2。
本题难度:困难
4、填空题 (19分) (1)利用H2S废气制取氢气的方法有多种。
①高温热分解法:已知:H2S(g)  H2(g)+1/2S2(g)ΔH在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol/L测定H2S的转化率,结果见图。
H2(g)+1/2S2(g)ΔH在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol/L测定H2S的转化率,结果见图。
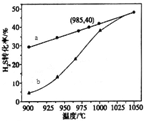
图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。ΔH_____0(填>,=或<):说明随温度的升高,曲线b向曲线a靠近的原因:________________________。
②电化学法:该法制氢过程的示意图如图。

反应池中反应的离子方程式是_____________________________;
反应后的溶液进入电解池,电解总反应的离子方程式为___________________________________。
(2)以Al和NiO(OH)为电极,NaOH溶液为电解液可以组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2。
①该电池的负极反应式__________________。②电池总反应的化学方程式__________________。
(3)某亚硝酸钠固体中可能含有碳酸钠和氢氧化钠,现测定亚硝酸钠的含量。
已知:5NaNO2+2KMnO4+3H2SO4=5NaNO3+2MnSO4+K2SO4+3H2O
称取4.000g固体,溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L,酸性KMnO4溶液进行滴定,实验所得数据如下表所示;
滴定次数
| 1
| 2
| 3
| 4
|
KMnO4溶液的体积/ml
| 20.60
| 20.02
| 20.00
| 19.98
|
①滴入最后一滴酸性KMnO4溶液,溶液___________,30秒内不恢复,可判断达到滴定终点。
②第一组实验数据出现异常,造成这种异常的原因可能是____________(填序号)。
A.酸式滴定管用蒸馏水洗净后未用标准液润洗;
B.锥形瓶洗净后未干燥;
C.滴定终了仰视读数
③根据表中数据,计算所得固体中亚硝酸钠的质量分数_____________。
参考答案:(19分)(1) ① >(2分),温度升高,反应速率加快,达到平衡所需的时间缩短(或温度升高,反应速率加快,相同时间内更快达到平衡) (2分)
②2Fe3+ + H2S==2Fe2++S↓+2H+(2分)2Fe2+ + 2H+ 2Fe3++H2↑(2分)
2Fe3++H2↑(2分)
(2)①Al-3e- + 4OH-==AlO2-+2H2O (2分)
②Al+3NiO(OH)+NaOH+3H2O="Na" AlO2+3Ni(OH)2 (2分)
(3)①由无色变为紫红色(2分);②A、C (2分;③86.25%(3分);
本题解析:(1) ①根据图像a可知:升高温度,H2S的平衡转化率增大,说明升高温度,平衡正向移动,正反应方向是吸热反应,所以ΔH>0;随温度的升高,曲线b向曲线a靠近的原因是温度升高,反应速率加快,达到平衡所需的时间缩短,所以曲线b向曲线a靠近;②根据图示可知:在反应池中反应的离子方程式是2Fe3+ + H2S="=" 2Fe2++S↓+2H+;反应后的溶液中含有FeCl2、HCl把它们加入进电解池,由于阳离子放电能力:H+>Fe2+,所以在阴极发生反应:2H++2e-=H2↑;离子的放电能力:Fe2+>Cl->OH-,所以在阳极发生反应:2Fe2+-2e-= 2Fe3+↑;电解总反应的离子方程式为2Fe2+ + 2H+ 2Fe3++H2↑;(2) ①以Al和NiO(OH)为电极,NaOH溶液为电解液可以组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2。由于活动性:Al> NiO(OH),所以Al为负极,该电池的负极反应式是Al-3e-+ 4OH-=AlO2-+2H2O;②电池总反应的化学方程式是Al+3NiO(OH)+NaOH+3H2O="Na" AlO2+3Ni(OH)2 ;(3) ①NaNO2有还原性,KMnO4有氧化性,二者会发生氧化还原反应而使酸性KMnO4溶液的紫色褪去,因此滴入最后一滴酸性KMnO4溶液,溶液由无色变为紫红色,半分钟内不褪色,可判断达到滴定终点。②A.酸式滴定管用蒸馏水洗净后未用标准液润洗;则同样的还原剂消耗的KMnO4溶液体积偏大,正确;B.锥形瓶洗净后未干燥,由于反应物的物质的量不变,所以对测定的物质浓度不产生影响,错误;C.滴定终了仰视读数,会是消耗的氧化剂的溶液体积偏大,正确;③根据表中数据,可知第一次误差太大,舍去,V(KMnO4)= (20.02+20.00+19.98)÷3=20.00ml;n(KMnO4)= V(KMnO4)×0.1000mol/L=" 0.02L" × 0.1000mol/L=2×10-3mol,则根据方程式中物质之间的物质的量关系可知n(NaNO2)=5/2n(KMnO4)= 5×10-3mol,所以所得固体中亚硝酸钠的质量分数是[(5×10-3mol×69g/mol) ×10]÷4.000g =3.450g÷ 4.000g=86.25%。
2Fe3++H2↑;(2) ①以Al和NiO(OH)为电极,NaOH溶液为电解液可以组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2。由于活动性:Al> NiO(OH),所以Al为负极,该电池的负极反应式是Al-3e-+ 4OH-=AlO2-+2H2O;②电池总反应的化学方程式是Al+3NiO(OH)+NaOH+3H2O="Na" AlO2+3Ni(OH)2 ;(3) ①NaNO2有还原性,KMnO4有氧化性,二者会发生氧化还原反应而使酸性KMnO4溶液的紫色褪去,因此滴入最后一滴酸性KMnO4溶液,溶液由无色变为紫红色,半分钟内不褪色,可判断达到滴定终点。②A.酸式滴定管用蒸馏水洗净后未用标准液润洗;则同样的还原剂消耗的KMnO4溶液体积偏大,正确;B.锥形瓶洗净后未干燥,由于反应物的物质的量不变,所以对测定的物质浓度不产生影响,错误;C.滴定终了仰视读数,会是消耗的氧化剂的溶液体积偏大,正确;③根据表中数据,可知第一次误差太大,舍去,V(KMnO4)= (20.02+20.00+19.98)÷3=20.00ml;n(KMnO4)= V(KMnO4)×0.1000mol/L=" 0.02L" × 0.1000mol/L=2×10-3mol,则根据方程式中物质之间的物质的量关系可知n(NaNO2)=5/2n(KMnO4)= 5×10-3mol,所以所得固体中亚硝酸钠的质量分数是[(5×10-3mol×69g/mol) ×10]÷4.000g =3.450g÷ 4.000g=86.25%。
考点:考查温度与化学反应速率、化学平衡的关系、原电池和电解池的反应原理的应用、电极反应式的书写、滴定终点的判断、误差分析、滴定法在物质含量测定的应用的知识。
本题难度:困难
5、选择题 下列各项中表达正确的是
①水分子球棍模型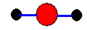 ②Na+结构示意图为
②Na+结构示意图为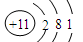
③Fe3O4中氧元素的化合价是-2? ④聚乙烯单体结构简式为CH2=CH2
⑤Na2O2电子式为 ? ⑥
? ⑥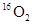 与
与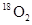 互为同分异构体
互为同分异构体
A.①③
B.③④
C.②⑤
D.④⑥
参考答案:B
本题解析:
分析:①水分子中,键角为108.5°;
②Na+离子核外电子数为10;
③四氧化三铁中氧元素的化合价为-2价;
④根据加聚反应找单体的方法来找单体;
⑤过氧化钠是离子化合物,由钠离子与过氧根离子构成;
⑥根据构成同分异构体的条件来解决;
解:①水分子中,键角为108.5°,球棍模型不是直线型,故①错误;
②Na+离子核外电子数为10,不是11,故②错误;
③四氧化三铁实质是一种铁酸盐,氧元素的化合价为-2价,故③正确;
④合成聚乙烯的单体是乙烯,结构简式为:CH2═CH2,故④正确;
⑤过氧化钠是离子化合物,由钠离子与过氧根离子构成,电子式为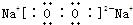 ,故⑤错误;
,故⑤错误;
⑥因构成同分异构体的条件:(1)化合物 (2)分子式相同(3)结构不同,而16O2与18O2为单质,故⑥错误.
故选B.
本题难度:一般