微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 共价键、离子键和分子间作用力是构成物质微粒间的不同的作用方式,下列物质中只含有上述一种作用的是()
A.干冰
B.氯化钠
C.氢氧化钠
D.碘
参考答案:B
本题解析:干冰中含有极性键和分子间作用力;氯化钠中含有离子键;氢氧化钠中含有离子键和极性键;碘单质中含有非极性键和分子间作用力,答案选B。
点评:一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键。而分子间作用力不是化学键,只是构成物质微粒中间的一种作用力。
本题难度:简单
2、填空题 (10分)(1)(6分)向盛有硫酸铜水溶液的试管里逐渐滴加氨水至过量,观察到的实验现象是:?其反应的离子方程式为:?.?
(2)(4分)利用VSEPR理论推测下列分子或离子的空间构型:CO32-和SO32-的空间构型分别为?和??。其中心原子的杂化方式分别是?和?
参考答案:(1)(6分)形成蓝色沉淀,继续添加氨水蓝色沉淀溶解,得到深蓝色的透明溶液。(2分)? Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+(2分)
Cu(OH)2+4NH3?H2O="[" Cu(NH3)4] 2++2OH-+4H2O(2分)
(2)(4分)平面三角形?三角锥形? sp2? sp3?(各1分)
本题解析:(1)硫酸铜和氨水反应生成蓝色的氢氧化铜沉淀,但氨水过量时,氢氧化铜能溶解在氨水中形成配合物,是由现象是形成蓝色沉淀,继续添加氨水蓝色沉淀溶解,得到深蓝色的透明溶液。离子方程式为Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+、
Cu(OH)2+4NH3?H2O="[" Cu(NH3)4] 2++2OH-+4H2O。
(2)CO32-和SO32-的中心原子含有的孤对电子分别是(4+2-2×3)÷2=0、(6+2-2×3)÷2=1,是由前者是平面三角形,后者三角锥形。因此中心原子的杂化类型分别是sp2杂化和sp3杂化。
本题难度:一般
3、选择题 常压下,苯的沸点低于甲苯,熔点却高于甲苯。苯的熔点更高的原因可能是
A.苯具有芳香性
B.苯中的化学键强度更强
C.苯分子间作用力更小
D.固态时苯分子排列更紧密
参考答案:D
本题解析:与甲苯相比,苯具有高度的对称性,在固体中紧密排列,而具有较高熔点(苯为5.5,甲苯-95),故选D.
本题难度:一般
4、选择题 某碳氢化合物分子的结构式如图: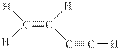 ,下列有关该分子的叙述正确的是(?)
,下列有关该分子的叙述正确的是(?)
A.该分子含5个σ键,3个π键
B.该分子是非极性分子
C.该分子的碳原子均是以 sp2杂化轨道参与成键
sp2杂化轨道参与成键
D.分子中有4个原子在同一直线上
参考答案:D
本题解析:略
本题难度:一般
5、选择题 下列物质中微粒的个数比不是1:1的是
A.NaHCO3晶体中的阴离子和阳离子
B.Na2O2固体中的阴离子和阳离子
C.重氢( H)原子中的质子和中子
D.NH3分子中的质子和电子
参考答案:B
本题解析:略
本题难度:一般