| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《键参数——键能、键长与键角》考点特训(2017年冲刺版)(八)
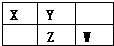 参考答案:X、Y、Z、W均为短周期元素,W原子的最外层电子数是其次外层电子数的7 8,则次外层外层为8个电子,最外层电子数为7,故W为Cl元素,由元素在周期表中的位置可知,X为氮元素、Y为氧元素、Z为硫元素, 本题解析: 本题难度:简单 2、选择题 下列说法正确的是(?) 参考答案:C 本题解析:明矾为离子化合物,是由离子构成的物质,A项正确;BF3中B的最外层为6电子结构、PCl5中P的最外层为10电子结构,B项错误;不成盐的非金属氧化物(NO、CO)都不是酸性氧化物、两性氧化物(Al2O3)不是碱性氧化物,C项正确;尿素和醋酸的相对分子质量相等,范德华力相等,故熔点差异不源于此,D项错误。 本题难度:一般 3、选择题 据最新报道,科学家发现了如下反应:O2+PtF6=O2(PtF6),已知O2(PtF6)为离子化合物,其中Pt的化合价为+5,对于此反应,下列说法正确的是 参考答案:D 本题解析: 本题难度:简单 4、选择题 实验测得 BeCl2为共价化合物,两个Be-Cl键间的夹角为180°。由此可见,BeCl2属于 参考答案:B 本题解析: 本题难度:简单 5、选择题 图为元素周期表短周期的一部分.关于A~G七种元素的叙述正确的是( ) |
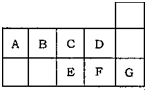
参考答案:A、E、F、G形成的单质分别为:S、Cl2、Ar,Ar为单原子分子,不存在共价键,故A错误;
B、C、D、E、F的阴离子分别为:O2-、F-、S2-、Cl-,其中O2-、F-核外有2个电子层,S2-、Cl-有3个电子层,则S2-、Cl-半径大于O2-、F-,根据核外电子排布相同的离子,核电核数越大半径越小判断离子半径,则有O2->F-,S2->Cl-,故S2->Cl->O2->F-,故B正确;
C、元素的非金属性越强,对应氢化物的稳定性就越大,已知非金属性B<C<D,B、C、D三种元素的氢化物的稳定性依次增强,故C错误;
D、A、B、E的氢化物分别是CH4、NH3、H2S,只有NH3能与硝酸化合,故D错误.
故选B.
本题解析:
本题难度:一般
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:高中化学知识点大全《铝盐》答题.. | ||