微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下表中评价不合理的是
A.A
B.B
C.C
D.D
参考答案:B
本题解析:分析:A.碳酸镁不溶于水,在离子反应中保留化学式;
B.反应生成硫酸钡和氢氧化铜沉淀;
C.电荷不守恒;
D.电解氯化钠溶液生成NaOH、氯气、氢气.
解答:A.向碳酸镁中加入稀盐酸的离子反应为MgCO3+2H+=CO2↑+H2O+Mg2+,评价合理,故A不选;
B.向硫酸铜溶液中加入氢氧化钡溶液的离子反应为Cu2++2OH-+Ba2++SO42-=BaSO4↓+Cu(OH)2↓,评价不合理,故B选;
C.向FeCl3溶液中加入Fe粉的离子反应为2Fe3++Fe=3Fe2+,评价合理,故C不选;
D.以石墨作电极电解氯化钠溶液的离子反应为2Cl-+2H2O 2OH-+H2↑+Cl2↑,评价合理,故D不选;
2OH-+H2↑+Cl2↑,评价合理,故D不选;
故选B.
点评:本题考查离子反应方程式的书写,明确发生的化学反应及离子反应方程式的书写方法即可解答,题目难度不大.
本题难度:困难
2、选择题 下列微粒中,哪一组中的化学键含有非极性共价键:①C2H6?②H2S?③CH2Cl2?④NH4+
A.①②③④
B.只有①
C.只有①③
D.只有②③
参考答案:B
本题解析:由同一种非金属元素组成的共价键是非极性键,据此可知,只有乙烷中含有非极性键,答案选B。
点评:该题是基础性试题的考查,主要是考查学生对非极性键判断的了解掌握情况,旨在巩固学生的基础,提高学生的能力,难度不大。
本题难度:一般
3、选择题 目前,科学家拟合成一种“二重构造”的球形分子,即把足球型的C60分子融进Si60的分子中,外面的硅原子与里面的碳原子以共价键结合,下列说法正确是
A.它是由两种单质组成的混合物
B.它是一种硅酸盐
C.它是一种新型化合物
D.它是一种高聚物
参考答案:C.
本题解析:高聚物分子量达到上万
本题难度:简单
4、填空题 (14分)某短周期元素的原子最外层电子数为次外层的2倍,其单质甲可发生如下反应:
甲 + 乙 丙 + 丁 + 水。
丙 + 丁 + 水。
(1)若丙为NO2。
①甲与乙反应的化学方程式为?。
②火箭常用NO2的二聚体N2O4作氧化剂,肼(N2H4)作燃料,已知:
N2(g)+2O2(g)=2NO2(g)? △H =-67.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g)?△H =-534.0kJ·mol-1
2NO2(g) N2O4(g)?△H =-52.7kJ·mol-1
N2O4(g)?△H =-52.7kJ·mol-1
试写出气态肼(N2H4)在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:?
___________________________________________________。
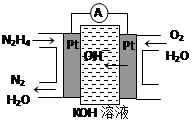
③肼又称联氨,广泛用于火箭推进剂、有机合成及燃料电池。肼燃料电池原理如右图所示,右边电极为?(填“正极”、“负极”),左边电极上发生的电极反应式为?。
(2)若丙为SO2。
①把乙滴入硫酸铜晶体中,观察到的现象是?。
②SO2气体有毒,多余的SO2气体常用足量的NaOH溶液吸收,写出吸收液中离子浓度由大到小的顺序:?。
③在氧化还原反应的过程中,氧化反应和还原反应同时发生,有关反应:
SO2-2e-+2H2O = SO42-+4H+反应的说法错误的是??。
A.该反应为氧化反应
B.上述反应中若转移电子物质的量为0.05mol,则生成溶液的PH值为1
C.Fe2(SO4)3、品红两种溶液都能使上述反应进行
D.通入Cl2会降低SO2的漂白作用
参考答案:(1)① C + 4HNO3(浓) CO2↑+ 4NO2↑+ 2H2O?(2分)
CO2↑+ 4NO2↑+ 2H2O?(2分)
②2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)?△H=-947.6 kJ· mol-1?(2分)
③正极?(2分)?N2H4-4e-+4OH-=N2+4H2O?(2分)
(2)①蓝色晶体变白色粉末?(2分)
② c(Na+) > c( SO32-) > c(OH-) > c( HSO3-) > c(H+)?(2分)
③ B? C?(2分)
本题解析:最外层电子数为次外层的2倍,则是碳元素。
(1)①丙是NO2,则乙是浓硝酸,和碳反应氧化还原反应,反应式为C + 4HNO3(浓) CO2↑+ 4NO2↑+ 2H2O。
CO2↑+ 4NO2↑+ 2H2O。
②考查盖斯定律的应用。根据①N2(g) + 2O2(g) =2NO2(g)、②N2H4(g) + O2(g) =N2(g) + 2H2O(g)和③NO2(g)  1/2N2O4(g)可知,如果②×2-①-③即得到2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g),所以反应热为-534.0 kJ/mol×2+67.7 kJ/mol+52.7 kJ/mol=-947.6kJ/mol。
1/2N2O4(g)可知,如果②×2-①-③即得到2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g),所以反应热为-534.0 kJ/mol×2+67.7 kJ/mol+52.7 kJ/mol=-947.6kJ/mol。
③右侧通入氧气,则是正极,左侧是负极,肼失去电子,发生氧化反应,电极反应式为N2H4-4e-+4OH-=N2+4H2O。
(2)若丙为SO2,则乙是浓硫酸,丁是CO2。①浓硫酸具有吸水性,可以吸收胆矾中的水分子,生成无水硫酸铜,所以蓝色晶体变白色粉末。
②SO2和氢氧化钠反应生成亚硫酸钠,亚硫酸钠水解,溶液显碱性。所以浓度大小顺序为c(Na+) > c( SO32-) > c(OH-) > c( HSO3-) > c(H+)。
③反应失去电子,所以是氧化反应。每转移2mol电子,就生成4mol氢离子,所以若转移电子物质的量为0.05mol,则生成氢离子的物质的量为0.1mol,但溶液的体积是未知的,所以无法计算pH,B不正确。SO2使品红溶液褪色,不是氧化还原反应,C不正确。氯气具有氧化性,SO2具有还原性,二者发生氧化还原反应,生成硫酸和盐酸,降低漂白性,D正确。
本题难度:一般
5、选择题 下列各组热化学方程式中,△H1<△H2的是
①C(s)+O2(g)===CO2(g) △H1 C(s)+O2(g)="==CO(g) " △H2
②S(s)+O2(g)===SO2(g) △H1 S(g)+O2(g)===SO2(g) △H2
③H2(g)+O2(g)===H2O(l) △H1 2H2(g)+O2(g)===2H2O(l) △H2
④CaCO3(s)===CaO(s)+CO2(g) △H1 CaO(s)+H2O(l)===Ca(OH)2(s) △H2
A.①
B.②③④
C.④
D.①②③