|
高中化学必备知识点《化学平衡》试题强化练习(2017年最新版)(十)
2017-03-05 14:27:30
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在容积为2 L的恒容密闭容器中,一定温度下,发生反应:aM(g)+bN(g) cQ(g)。气体M、N、Q的物质的量随时间的变化如图所示, cQ(g)。气体M、N、Q的物质的量随时间的变化如图所示,
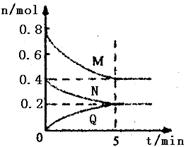
则下列叙述正确的是
A.该温度下此反应的平衡常数的值K=25/4
B.平衡时,M的转化率为50%,若条件改为恒温恒压,则达平衡时M的转化率小于50%
C.若开始时向容器中充入2mol M和1mol N,达到平衡时,M的体积分数小于50%
D.在5 min时,再向体系中充入少量He,重新达到平衡前v(正)>v(逆)
|
参考答案:C
本题解析:△n(M)=0.8mol-0.4mol=0.4mol,△n(N)=0.4mol-0.2mol=0.2mol,△n(Q)=0.2mol,所以a:b:c=2:1:1,化学方程式为2M(g)+N(g) Q(g),A.平衡时,c(M)=0.4mol÷2L=0.2mol/L,c(N)=c(Q)=0.2mol÷2L=0.1mol/L,K= Q(g),A.平衡时,c(M)=0.4mol÷2L=0.2mol/L,c(N)=c(Q)=0.2mol÷2L=0.1mol/L,K=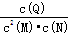 = = =25,故A错误;B.平衡时,M的转化率为50%,若条件改为恒温恒压,由于正方应是体积减小的可逆反应,因此保存恒温恒压有利于平衡向正反应方向进行,则达平衡时M的转化率大于50%,故B错误;C.在该条件下,M的体积分数为: =25,故A错误;B.平衡时,M的转化率为50%,若条件改为恒温恒压,由于正方应是体积减小的可逆反应,因此保存恒温恒压有利于平衡向正反应方向进行,则达平衡时M的转化率大于50%,故B错误;C.在该条件下,M的体积分数为: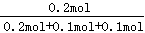 ×100%=50%。由于该反应前气体体积大于反应后气体体积,充入比原反应更多的反应物时,可逆反应进行程度比原平衡大,所以M的体积分数小于50%,故C正确;D.向体系中充入少量He,化学平衡不移动,即v(正)=v(逆),故D错误,答案选C。 ×100%=50%。由于该反应前气体体积大于反应后气体体积,充入比原反应更多的反应物时,可逆反应进行程度比原平衡大,所以M的体积分数小于50%,故C正确;D.向体系中充入少量He,化学平衡不移动,即v(正)=v(逆),故D错误,答案选C。
考点:考查化学平衡图象、影响平衡的因素、平衡常数影响因素、化学反应速率的计算等
本题难度:一般
2、选择题 在体积不变的密闭容器中充入1 mol NH3,建立平衡:2NH3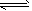 3H2+N2,测得NH3的分解率为x%。若在其他条件不变时,再充入1 mol NH3,待建立新的平衡后,又测得NH3的分解率为y%,则x与y关系正确的是 3H2+N2,测得NH3的分解率为x%。若在其他条件不变时,再充入1 mol NH3,待建立新的平衡后,又测得NH3的分解率为y%,则x与y关系正确的是
[? ]
A.x>y
B.x<y
C.x=y
D.x≥y
参考答案:A
本题解析:
本题难度:一般
3、填空题 恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示。已知:2SO2(g)+O2(g) 2SO3(g) 2SO3(g)
ΔH="-196.6" kJ/mol。
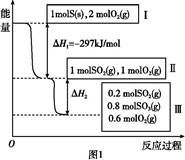 
请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式: 。
(2)ΔH2= 。
(3)恒温恒容时,1 mol SO2和2 mol O2充分反应,放出热量的数值比
参考答案:
本题解析:
本题难度:困难
4、填空题 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)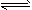 CO(g)+H2O(g)其化学平衡常数K与温度t的关系如下表 CO(g)+H2O(g)其化学平衡常数K与温度t的关系如下表
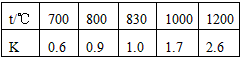
回答下列问题
(1)该反应的化学平衡常数表达式为K=___________。
(2)该反应为___________反应(填“吸热”“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是___________
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为_______℃
参考答案:(1)K=[c(CO)·c(H2O)]/[c(CO2)·c(H2)]
(2)吸热
(3)BC
(4)830
本题解析:
本题难度:一般
5、选择题 对化学反应限度的叙述,错误的是( )
A.化学反应的限度不可改变
B.反应达到限度时,正逆反应速率相等
C.化学反应的限度与时间的长短无关
D.任何可逆反应都有一定的限度
参考答案:A、当外界条件变化时,如正反应速率和逆反应速率不相等,则化学反应的限度可发生变化,故A错误;
B、化学反应达到限度时,正逆反应速率相等,物质的浓度不再发生变化,故B正确.
C、化学反应的限度只与反应物的性质、温度、浓度和压强有关,与反应的时间长短无关,故C正确;
D、可逆反应中,当正逆反应相等时,达到反应限度,可逆反应不可能完全反应,存在反应限度,故D正确.
故选A.
本题解析:
本题难度:一般
|