微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环。
(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下转化生成甲醇蒸汽和水蒸气。下图表示恒压容器中0.5 mol CO2和1.5 mol H2转化率达80%时的能量变化示意图。
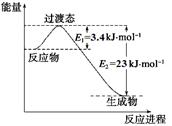
①写出该反应的热化学方程式: 。
②能判断该反应达到化学平衡状态的依据是 。
a.容器中压强不变 b.H2的体积分数不变
c.c(H2)=3c(CH3OH) d.容器中密度不变
e.2个C=O断裂的同时有6个H-H断裂。
(2)人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.下图是通过人工光合作用制备HCOOH原理的示意图。根据要求回答问题:
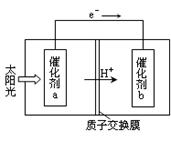
①该过程是将 转化为 。(以上两空选填“电能”“太阳能”“化学能”)
②催化剂b表面的电极反应方程式为 。
(3)某国科研人员提出了使用氢气和汽油(汽油化学式用C8H18表示)混合燃料的方案,以解决汽车CO2的排放问题。该方案主要利用储氢材料CaH2产生H2和用汽油箱贮存汽油供发动机使用,储氢系统又捕集汽油燃烧产生的CO2,该系统反应如下图所示:
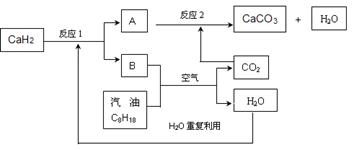
解决如下问题:
①写出CaH2的电子式 。
②反应1中氧化剂与还原剂的物质的量之比是: 。
③如该系统反应均进行完全,试写出该系统总反应的化学方程式 。
参考答案:
(1)①CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H =-49 kJ·mol-1(3分))②bd (2分,多选错选0分,漏选1个给1分)
CH3OH(g)+H2O(g) △H =-49 kJ·mol-1(3分))②bd (2分,多选错选0分,漏选1个给1分)
(2)①太阳能 化学能(各1分) ②CO2+2e-+2H+=HCOOH(2分)
(3)①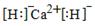 (2分)
(2分)
②2:1 (2分) ③16CaH2+ 2C8H18+41O2=16CaCO3+34 H2O(2分)
本题解析:(1)①由所给能量变化示意图可知,1mol CO2和3molH2转化率达100%时放出热量49kJ,所以该反应的热化学方程式为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H =-49 kJ·mol-1
CH3OH(g)+H2O(g) △H =-49 kJ·mol-1
②a、该反应是在恒压容器中进行,所以压强始终不变,不能判断该反应达到化学平衡状态,错误;b、达平衡时,各物质的含量都不再改变,氢气的体积分数恒定,可以判断该反应达到化学平衡状态,正确c、平衡时,氢气和甲醇的浓度不一定具备化学计量数的比例关系,不能判断该反应达到化学平衡状态,错误;d、由于该反应是反应前后气体的物质的量改变的反应,当压强不变时,容器体积在减小,密度增大,当平衡时气体密度不再增大,保持不变,能判断该反应达到化学平衡状态,正确;e、反应的任何状态时都有2个C=O断裂的同时有6个H-H断裂,不能判断该反应达到化学平衡状态,错误,答案选bd;
(2)①该图是利用太阳能将二氧化碳转化为HCOOH,所以是把太阳能转化为化学能;②根据电子的流动方向,催化剂b相当于原电池的正极,发生还原反应,所以发生的反应为CO2+2e-+2H+=HCOOH;
(3)①CaH2是离子化合物,其电子式为 ;
;
②反应1是CaH2与H2O反应生成氢氧化钙和氢气,反应中CaH2作还原剂,水作氧化剂,可写出发生的化学方程式CaH2+2H2 www.91eXam.orgO=Ca(OH)2+H2↑,所以氧化剂与还原剂的物质的量之比是2:1;
③由反应的流程图可知,最终产物是CaCO3、H2O。反应1生成的氢气与氧气反应生成水,汽油与氧气反应生成二氧化碳和水,其中二氧化碳用于和反应1产生的氢氧化钙的反应,将发生反应的化学方程式叠加,消去中间产物二氧化碳、氢气、氢氧化钙,最后的产物只有水和碳酸钙,所以总反应方程式为16CaH2+ 2C8H18+41O2=16CaCO3+34H2O。
考点:考查热化学方程式、电子式、电极反应式的书写,化学平衡的判断,能量转化的判断,方程式叠加法的应用
本题难度:困难
2、选择题 关于如图装置的叙述,不正确的是(?)
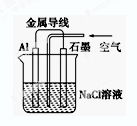
A.铝是负极,铝片上析出无色气体
B.石墨是正极,石墨棒上析出黄绿色气体
C.溶液中两电极间产生白色沉淀
D.溶液中Na+向石墨方向移动
参考答案:AB
本题解析:铝、石墨、氯化钠溶液和导线形成原电池,铝比石墨容易失去电子,则铝是负极,石墨是正极,负极反应式为Al—3e—=Al3+,则铝片上无气体产生,故A错;由于氯化钠溶液显中性,因此铝片发生吸氧腐蚀,则正极反应式为O2+4e—+2H2O=4OH—,没有氯气产生,故B错;负极反应产生的铝离子移向正极,正极反应产生的氢氧根离子移向负极,二者在溶液中相遇时反应生成氢氧化铝沉淀,故C正确;原电池中阳离子移向正极,钠离子是阳离子,石墨是正极,故D正确。
本题难度:一般
3、选择题 锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。锂离子电池放电时电极反应式为负极反应:C6Li-xe-==C6Li1-x+xLi+(C6Li表示锂原子嵌入石墨形成复合材料)正极反应:Li1-xMO2+xLi++xe-==LiMO2(LiMO2表示含锂的过渡金属氧化物)下列有关说法正确的是
A.锂离子电池充电时电池反应为C6Li+Li1-xMO2==LiMO2+C6Li1-x
B.电池反应中,锂、锌、银、铅各失去1mol电子,金属锂所消耗的质量最小
C.锂离子电池放电时电池内部Li+向负极移动
D.锂离子电池充电时阴极反应为C6Li1-x+xLi++x e-==C6Li
参考答案:B、D
本题解析:由负极反应:C6Li-xe-==C6Li1-x+xLi+和正极反应:Li1-xMO2+xLi++xe-==LiMO2得原电池总反应为C6Li+ Li1-xMO2==C6Li1-x+LiMO2,而充电时电池反应与此相反,故A错D对,又因原电池内电路中电流方向是由负极流向正极,阳离子应向正极移动,故C错误。锂摩尔质量很小,故锂失去1mol电子,锂所消耗的质量最小。]
本题难度:一般
4、选择题 有A、B、C、D四块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极; ②C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由D 导线
导线 C ; ③ A、C用导线相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡; ④B、D用导线相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应。据此,判断四种金属的活动性顺序是
C ; ③ A、C用导线相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡; ④B、D用导线相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应。据此,判断四种金属的活动性顺序是
A. A>B>C>D B. A>C>D>B C. C>A>D>B D.C>B>D>A
参考答案:B
本题解析:由题意可知:①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极,则活泼性:A>B;②原电池中,电流从正极流经外电路流向负极,C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由D→导线→C,则活泼性:C>D;③A、C相连后,同时浸入稀硫酸溶液中,C极产生大量气泡,说明C极是正极,则活泼性:A>C;④B、D相连后,同时浸入稀硫酸溶液中,D极发生氧化反应,D极是负极,则活泼性:D>B;综上所述,金属活泼性顺序是:A>C>D>B,选B。
考点:考查原电池原理的应用、金属活动性比较。
本题难度:一般
5、选择题 某原电池装置如图所示,电池总反应为2Ag+Cl2===2AgCl。下列说法正确的是
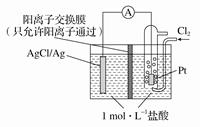
A.当电路中转移0.1 mol e-时,交换膜左侧溶液中约减少0.2 mol离子
B.放电时,交换膜两侧溶液中均有大量白色沉淀生成
C.若用NaCl溶液代替盐酸,则电池总反应随之改变
D.正极反应为AgCl+e-===Ag+Cl-