微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
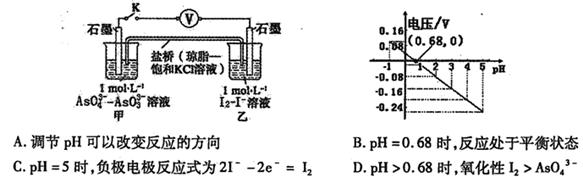
1、选择题 某实验小组依据反应 设计如图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是
设计如图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是
2、选择题 对达到平衡状态的可逆反应X+Y Z+W,在其他条件不变的情况下,增大压强,反应速率变化如右图所示
Z+W,在其他条件不变的情况下,增大压强,反应速率变化如右图所示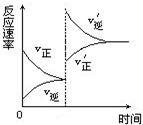 ,则图像中关于X、Y、Z、W四种物质的聚集状态为:
,则图像中关于X、Y、Z、W四种物质的聚集状态为:
A.Z、W均为气体,X、Y中有一种是气体
B.Z、W中有一种是气体,X、Y皆非气体
C.X、Y、Z、W皆非气体
D.X、Y均为气体,Z、W中有一种为气体
3、选择题 对于平衡体系mA(g)+nB(g)===pC(g)+qD(g)? ΔH<0。下列结论中错误的是
A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m∶n
C.若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a
D.若改变条件使平衡体系中物质的浓度发生变化,则平衡一定发生移动
4、计算题 丙酮和碘在酸性溶液中发生下列反应:CH3COCH3+I2→CH3COCH2I +H++I-。25℃ 时,该反应的速率由下列经验式决定:v=2.73×10-5c(CH3COCH3)c(H+) mol/(L·s)。25℃时,如果c(I2)、c(CH3COCH3)、
c(H+)的起始浓度依次是0.01mol/L、0.1mol/L、0.01mol/L,求:
(1)反应开始时的速率是多少?
(2)当溶液中的I2消耗一半时,反应速率比开始时慢还是快?
5、选择题 质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2。
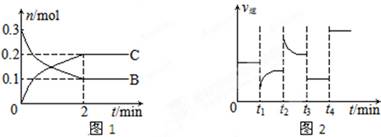
下列有关说法正确的是(?)
A.x=2,反应开始2 min内,v(B)=0.1 mol/(L·min)
B.t1时改变的条件是降温,平衡逆向移动
C.t2时改变的条件可能是增大c(C),平衡时B的物质的量分数增大
D.t3时可能是减小压强,平衡不移动;t4时可能是使用催化剂,c(B)不变