微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列实验操作中错误的是( )
A.萃取操作时,所选萃取剂的密度没有特别限制
B.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
C.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
D.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
参考答案:D
本题解析:
本题难度:简单
2、简答题 铬酸铅俗称铬黄,不溶于水.广泛用于涂料、油墨、漆布、塑料和文教用品等工业.实验室模拟工业上用铬污泥(含有Cr2O3、Fe2O3、Al2O3、SiO2等)制备铬黄的工艺流程如下:

(1)将铬污泥粉碎的目的是______.操作a的名称为______.
(2)废渣的主要成分是Al(OH)3和Fe(OH)3.已知25℃时,Al(OH)3的Ksp=1.3×10-33,则该温度下反应Al3++3H2O
?Al(OH)3+3H+的平衡常数为______.
(3)写出加入30%H2O2过程中发生的离子反应方程式:______.
(4)加入Pb(NO3)2沉淀CrO42-时,检验沉淀是否完全的方法是______.
(5)在废液中加入10%明矾溶液发生反应的化学方程式为______.
参考答案:(1)将铬污泥粉碎可以增大与盐酸的接触面积,有利于提高浸取率;
由流程图可知,操作a是把溶液与不溶物分离,应是过滤;
故答案为:增大接触面积,提高浸取率;过滤;
(2)Ksp[Al(OH)3]=c(Al3+)?c3(OH-)=1.3×10-33,水解平衡常数Kh=c3(H+)c(Al3+),故Ksp[Al(OH)3]?Kh=(kw)3=(10-14)3=10-42,所以Kh=10-421.3×10-33=7.7×10-10;
故答案为:7.7×10-10;
(3)由流程图可知,加入30%H2O2的目的是在碱性条件下将CrO2-氧化为CrO42-,同时生成水,
反应离子方程式为3H2O2+2CrO2-+2OH-=2CrO42-+4H2O;
故答案为:3H2O2+2CrO2-+2OH-=2CrO42-+4H2O;
(4)检验沉淀是否完全的方法是:静置分层后,取上层清液,继续滴加Pb(NO3)2溶液,无沉淀生成,说明沉淀完全;
故答案为:静置分层后,取上层清液,继续滴加Pb(NO3)2溶液,无沉淀生成,说明沉淀完全;
(5)废液中含有Pb(NO3)2,废液中加入10%明矾溶液目的是将Pb2+转化为PbSO4沉淀,
反应方程式为2Pb(NO3)2+KAl(SO4)2=2PbSO4↓+KNO3+Al(NO3)3;
故答案为:2Pb(NO3)2+KAl(SO4)2=2PbSO4↓+KNO3+Al(NO3)3.
本题解析:
本题难度:一般
3、选择题 有下列五瓶溶液,其所含离子、分子总数的大小顺序是
①10mL?0.60?mol·L-1NaOH水溶液? ②20mL?0.50?mol·L-1?H2SO4水溶液?
③30mL?0.40?mol·L-1?HCl水溶液? ④40mL?0.30?mol·L-1?CH3COOH溶液? ⑤50mL?0.20?mol·L-1蔗糖水溶液
A.①>②>③>④>⑤
B.②>①>③>④>⑤
C.②>③>④>①>⑤
D.⑤>④>③>②>①
参考答案:D
本题解析:因为问的是各瓶溶液所含离子、分子总数的大小,溶质的量小,这就取决于溶液中的水的多少,所以哪种溶液体积大,哪种所含离子、分子总数就多。故有⑤>④>③>②>①。
本题难度:简单
4、选择题 下列化学实验或操作能够达到目的是( )
A.欲除去蛋白质溶液中的NaCl而又不改变它的性质,可加入适量的BaCl2溶液,再过滤
B.将溴乙烷和NaOH溶液共热后,再滴加AgNO3溶液可检验其中的溴元素
C.为除去含有Mg(OH)2和Ca(OH)2的浊液中的Ca(OH)2,可向其中加入足量的MgCl2,充分反应后,过滤
D.除去乙酸乙酯中混有少量乙酸:加入乙醇和浓硫酸,加热、静置、分液
参考答案:A.BaCl2是重金属盐能使蛋白质发生变性,变性是不可逆过程,故A错误;
B.氢氧根会和银离子结合形成AgOH,但是AgOH不能在水中存在,会生成沉淀,故B错误;
C.Mg(OH)2比Ca(OH)2更难溶,由水中的离子平衡可得当往悬浊液加MgCl2时,Mg2+浓度增加,所以会以Mg(OH)2的形式沉淀出来,而OH-浓度有限,所以Ca(OH)2中的Ca又会以离子形式存在于溶液中,过滤即可除掉,故C正确;
D.如果加入乙醇和浓硫酸,虽然可以反应掉部分乙酸,但是又会引入乙醇,而且加热会使它挥发,最好不用,一般加入少量碳酸钠即可,故D错误.
故选C.
本题解析:
本题难度:一般
5、选择题 下列实验装置中能达到实验目的的是(? )
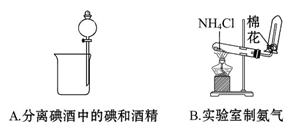
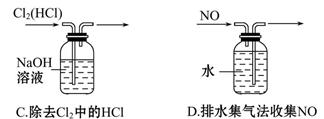
参考答案:D
本题解析:不能用分液法分离碘酒中的碘和酒精,因为二者互溶。NH4Cl受热分解,冷却后又重新生成NH4Cl,故很难收集到NH3。C项中Cl2和HCl均可与NaOH溶液反应,故不能用NaOH溶液除去Cl2中的HCl,而应采用饱和食盐水除去Cl2中的HCl
本题难度:一般