微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 一定温度下,在密闭容器中,发生反应: 2NO2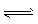 2NO+O2,经过一定时间后,测得混合气中NO2浓度为0.06 mol·L-1, O2的浓度为0.12 mol·L-1,且各物质的浓度不再发生变化。
2NO+O2,经过一定时间后,测得混合气中NO2浓度为0.06 mol·L-1, O2的浓度为0.12 mol·L-1,且各物质的浓度不再发生变化。
求:
(1)NO2的起始浓度? ;
(2)此时NO2的转化率? 。
参考答案:(1)0.3 mol/L
(2)80%
本题解析:
本题难度:一般
2、选择题 可逆反应2HI(g)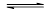 I2(g)+H2(g)在密闭容器中进行,当下列中的四项中的某项不随时间变化时,不能说明反应达到平衡的是(? )
I2(g)+H2(g)在密闭容器中进行,当下列中的四项中的某项不随时间变化时,不能说明反应达到平衡的是(? )
A.各组分的物质的量
B.混合物的温度
C.容器内压强
D.混合气体的颜色
参考答案:C
本题解析:A正确,各组分的物质的量不变相当于各组分的浓度不变,反应达平衡;B正确,化学反应的基本特征是有新的物质变化,同时伴随着能量变化;C错,该反应为等体积反应,平衡与否体系内压强均不变;D正确,混合气体的颜色不变即浓度不变,反应达平衡;
本题难度:一般
3、选择题 下列变化不能用勒夏特列原理解释的是(? )
A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率
B.已知反应 H2(g)+ I2(g) 2HI(g)达平衡, 加压后混合气体颜色变深
2HI(g)达平衡, 加压后混合气体颜色变深
C.红棕色的NO2加压后颜色先变深再变浅
D.实验室用排饱和食盐水的方法收集氯气
参考答案:B
本题解析:A.在工业上制取硫酸的关键反应是2SO2+O2 2SO3。由于该反应是可能反应。若使用过量的氧气,即增大了氧气的浓度,关键平衡移动原理:增大反应物的浓度,平衡正向移动,可以使更多的SO2转化为SO3。因此二氧化硫的转化率提高。正确。B. 已知反应 H2(g)+ I2(g)
2SO3。由于该反应是可能反应。若使用过量的氧气,即增大了氧气的浓度,关键平衡移动原理:增大反应物的浓度,平衡正向移动,可以使更多的SO2转化为SO3。因此二氧化硫的转化率提高。正确。B. 已知反应 H2(g)+ I2(g) 2HI(g)达平衡,由于该反应是反应前后气体体积相等的可能反应。加压平衡不发生移动。但是由于加压后单位体积内的I2的物质的量增大,所以浓度增大,混合气体颜色变深。正确。C.在密闭容器内NO2存在化学平衡:2NO2(g)
2HI(g)达平衡,由于该反应是反应前后气体体积相等的可能反应。加压平衡不发生移动。但是由于加压后单位体积内的I2的物质的量增大,所以浓度增大,混合气体颜色变深。正确。C.在密闭容器内NO2存在化学平衡:2NO2(g) N2O4(g)NO2是红棕色的气体,N2O4是无色气体。加压后单位体积内NO2增多,所以气体的颜色先变深。由于该反应的正反应是气体体积减小的反应。增大压强,化学平衡向正反应方向移动,所以气体的颜色又逐渐变浅。但是颜色比加压前深。正确。D.氯气在水中存在化学平衡:Cl2+H2O
N2O4(g)NO2是红棕色的气体,N2O4是无色气体。加压后单位体积内NO2增多,所以气体的颜色先变深。由于该反应的正反应是气体体积减小的反应。增大压强,化学平衡向正反应方向移动,所以气体的颜色又逐渐变浅。但是颜色比加压前深。正确。D.氯气在水中存在化学平衡:Cl2+H2O H++Cl-+HclO。若水中存在NaCl。则食盐电离产生的Cl-会使c(Cl-)增大。根据平衡移动原理:增大生成物的浓度,平衡向逆反应方向移动。因此可以减小氯气在水中的溶解和反应而引起的消耗。故实验室用排饱和食盐水的方法收集氯气。正确。
H++Cl-+HclO。若水中存在NaCl。则食盐电离产生的Cl-会使c(Cl-)增大。根据平衡移动原理:增大生成物的浓度,平衡向逆反应方向移动。因此可以减小氯气在水中的溶解和反应而引起的消耗。故实验室用排饱和食盐水的方法收集氯气。正确。
本题难度:一般
4、填空题 化学反应原理在科研和生产中有广泛应用。
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应:
TaS2(s)+2I2(g) TaI4(g)+S2(g) ΔH>0(I)
TaI4(g)+S2(g) ΔH>0(I)
反应(Ⅰ)的平衡常数表达式K=________,若K=1,向某恒容容器中加入1 mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为________。
(2)如图所示,反应(Ⅰ)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净TaS2晶体,则温度T1________T2(填“>”“<”或“=”)。上述反应体系中循环使用的物质是________。
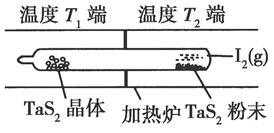
(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为________,滴定反应的离子方程式为______________________。
(4)25℃时,H2SO3 HSO3-+H+的电离常数Ka=1×10-2mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kh=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中
HSO3-+H+的电离常数Ka=1×10-2mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kh=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中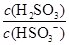 将________(填“增大”“减小”或“不变”)。
将________(填“增大”“减小”或“不变”)。
参考答案:(1)[c(TaI4)·c(S2)]/c2(I2) 66.7% (2)< I2 (3)淀粉 I2+H2SO3+H2O=4H++2I-+SO42-
(4)1×10-12 增大
本题解析:结合题给可逆反应的特点,应用化学平衡移动原理,分析化学平衡、电离平衡和水解平衡问题。
(1)反应(Ⅰ)中,TaS2为固体,则平衡常数表达式K=[c(TaI4)·c(S2)/c2(I2)]。设平衡时,I2转化的物质的量为x,则有
TaS2(s)+2I2(g) TaI4(g)+S2(g)
TaI4(g)+S2(g)
起始/mol?1?0?0
转化/mol ?x?0.5x?0.5x
平衡/mol?1-x ?0.5x ?0.5x
此时平衡常数K为1,则有[(0.5x)·(0.5x)]/(1-x)2=1,从而可得x=2/3 mol,I2(g)的转化率为(2/3 mol)/1 mol×100%≈66.7%。
(2)由题意可知,未提纯的TaS2粉末变成纯净TaS2晶体,要经过两步转化:①TaS2+2I2=TaI4+S2,②TaI4+S2=TaS2+2I2,即反应(Ⅰ)先在温度T2端正向进行,后在温度T1端逆向进行,反应(Ⅰ)的ΔH大于0,因此温度T1小于T2,该过程中循环使用的是I2。
(3)淀粉遇单质I2显蓝色,利用I2溶液滴定H2SO3时,常用淀粉作指示剂,达到终点时,溶液由无色变成蓝色,滴定反应的离子方程式为I2+H2SO3+H2O=4H++2I-+SO42-。
(4)H2SO3的电离常数Ka=[c(HSO3-)·c(H+)]/c(H2SO3)=1×10-2 mol·L-1,水的离子积常数KW=c(H+)·c(OH-)=1×10-14mol2·L-2,综上可得Ka=[c(HSO3-)·KW]/[c(H2SO3)·c(OH-)]。NaHSO3溶液中HSO3-的水解反应为HSO3-+H2O H2SO3+OH-,则水解平衡常数Kh=[c(H2SO3)·c(OH-)]/c(HSO3-)=KW/Ka=(1×10-14mol2·L-2)/(1×10-2mol·L-1)=1×10-12mol·L-1。NaHSO3溶液中加入少量I2,二者发生氧化还原反应,溶液中c(HSO3-)减小,HSO3-的水解程度增大,c(H2SO3)/c(HSO3-)将增大。
H2SO3+OH-,则水解平衡常数Kh=[c(H2SO3)·c(OH-)]/c(HSO3-)=KW/Ka=(1×10-14mol2·L-2)/(1×10-2mol·L-1)=1×10-12mol·L-1。NaHSO3溶液中加入少量I2,二者发生氧化还原反应,溶液中c(HSO3-)减小,HSO3-的水解程度增大,c(H2SO3)/c(HSO3-)将增大。
点拨:知识:平衡常数及转化率;平衡移动及影响因素;氧化还原滴定及指示剂的选择;电离平衡常数和水解平衡常数的计算。能力:考查考生的综合应用能力、分析问题和解决问题的能力,以及简单计算的能力。试题难度:较大。
本题难度:一般
5、选择题 向一密闭容器中充人1mol N2和3mol H2,在一定条件下发生反应N2+3H2 2NH3,下列有关说法正确的是(?)
2NH3,下列有关说法正确的是(?)
A.达到化学平衡时,正反应和逆反应的速率都为零
B.当符合3u正(N2)=u正(H2)时,反应达到平衡状态
C.达到化学平衡时,单位时间消耗amolN2,同时生成3amolH2
D.当N2、H2、NH3的分子数比为1∶3∶2,反应达到平衡状态
参考答案:C
本题解析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以选项A不正确,B中反应速率的方向是相同的,速率之比是相应的化学计量数之比,因此B中的关系始终是成立,B不正确。平衡时各种物质的浓度不再发生变化,但各种的浓度之间不一定满足某种关系,D不正确。C中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,正确,因此答案选C。
点评:该题是中等难度的试题,也是高考中的常见题型和考点。试题基础性强,难易适中,侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生的逻辑推理能力和发散思维能力。该题的关键是明确平衡状态的特点,然后结合具体的可逆反应方程式灵活运用即可。
本题难度:一般