微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列方法中可以说明2HI(g)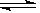 H2(g)+I2(g)已达到平衡的是(? )
H2(g)+I2(g)已达到平衡的是(? )
①单位时间内生成n mol H2的同时生成n mol HI?
②一个H—H键断裂的同时有两个H—I键断裂?
③百分组成w(HI)=w(I2)?④反应速率v(H2)=v(I2)=1/2v(HI)时?
⑤c(HI)∶c(H2)∶c(I2)=2∶1∶1时?⑥温度和体积一定时,容器内压强不再变化?
⑦温度和体积一定时,某一生成物浓度不再变化?
⑧条件一定,混合气体的平均相对分子质量不再变化?
⑨温度和体积一定时,混合气体的颜色不再变化?
⑩温度和压强一定时,混合气体的密度不再变化
A.②③⑤
B.①④⑦
C.②⑦⑨
D.⑧⑨⑩
参考答案:C
本题解析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以⑦正确。颜色的深浅和浓度有关系,所以选项⑨可以说明。反应前后气体的体积不变,因此气体的总物质的量、体积和压强始终是不变的,⑥不能说明。平衡时各种物质的浓度不再发生变化,但各种的浓度之间不一定满足某种关系,③⑤不能说明。①反应速率的方向相反,但不能满足速率之比是相应的化学计量数之比,不正确。②中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,正确。速率之比是相应的化学计量数之比,因此④中的关系始终是成立,不正确。密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,⑩不正确。混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,同样在反应过程中质量和物质的量始终是不变的,⑧不能说明,因此答案选C。
点评:该题是中等难度的试题,也是高考中的常见题型和考点。试题基础性强,难易适中,侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生的逻辑推理能力和发散思维能力。该题的关键是明确平衡状态的特点,然后结合具体的可逆反应灵活运用即可。
本题难度:简单
2、选择题 已知合成氨的反应为:N2(g)+3H2(g)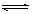 2NH3(g);△H=-QkJ·mo(Q>0)。
2NH3(g);△H=-QkJ·mo(Q>0)。
在同温同压下向密闭容器甲中通入lmolN2和3molH2,达平衡时,放出的热量为QlkJ;
向另一容积相同的密闭容器乙中通入0.5molN2和1.5 molH2,反应达平衡时,放出的热量为Q2kJ。则下列关系式正确的是
A.2Q2<Ql<Q
B.2Q2=Q1<Q
C.2Q2=Q1=Q
D.Ql<Q2<Q
参考答案:A
本题解析:
正确答案:A
甲中通入lmolN2和3molH2,不可能全部反应,达平衡时,放出的热量为QlkJ小于QkJ,同理,乙中通入0.5molN2和1.5 molH2,反应达平衡时,放出的热量为Q2kJ小于Q/2kJ,A正确。
本题难度:简单
3、计算题 (10分)如下图,向A中充入1molX、1molY,向B中充入2molX、2molY,起始时,V(A)=V(B)=a L。在相同温度和催化剂存在下,两容器中各自发生下述反应:

X + Y 2Z + W ;(X、Y、Z、W均为气体,正反应为放热反应),达平衡时,V(A)=1.2 a L。试回答:
2Z + W ;(X、Y、Z、W均为气体,正反应为放热反应),达平衡时,V(A)=1.2 a L。试回答:
⑴A中X的转化率α(A)?。
⑵A,B中X的转化率关系:α(A)?α(B)(填“>”、“<”、“=”)。
⑶打开K,一段时间又达到平衡,A的体积为?L(连通管中气体体积不计)。
参考答案:(1)40%? (2)>? (3)2.6a?
(4)c?正反应为放热反应,升高温度平衡向逆反应方向移动。
本题解析:(1)? X + Y 2Z + W
2Z + W
起始量(mol)? 1? 1? 0? 0
转化量(mol)? a? a? 2a? a
平衡量(mol)? 1-a? 1-a? 2a? a
因此有2/(2+a)=1/1.2,解得a=0.4mol
所以X的转化率是40%
(2)由于反应是体积增大的,所以在反应过程中A中的压强大于B中的压强。压强大,有利于平衡向正反应方向移动,转化率大,即A中X的转化率大于B中X的转化率。
(3)打开K之后,起始物质的物质的量之比是相同的,因此平衡是等效的。所以根据已知可知,平衡时容器的总体积应该是是1.2 a L×3=3.6aL,则A中的体积是3.6aL-aL==2.6aL。
本题难度:一般
4、选择题 已知可逆反应X(g)+Y(g)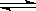 Z(g)(未配平)。温度为T0时,在容积固定的容器中发生反应各物质的浓度随时间变化的关系如图a所示。其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示。下列叙述正确的是(?)
Z(g)(未配平)。温度为T0时,在容积固定的容器中发生反应各物质的浓度随时间变化的关系如图a所示。其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示。下列叙述正确的是(?)

A.发生反应时,各物质的反应速率大小关系为:v(X)=" v(Y)=" 2v(Z)
B.图a中反应达到平衡时,Y的转化率为37.5%
C.T0℃时,该反应的平衡常数为33.3
D.该反应正反应的反应热△H<0
参考答案:C
本题解析:略
本题难度:一般
5、选择题 从下列叙述中能肯定判断某化学平衡发生移动的是( )
A.混合物中各组分的浓度改变
B.混合体系中气体密度发生变化
C.正、逆反应速率改变
D.反应物的转化率改变
参考答案:D
本题解析:对I2(g)+H2(g)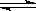 2HI(g)混合体系加压,平衡不移动,但各组分的浓度都变大,混合气体的密度变大,正逆反应速率变大,所以A、B、C都是错误的;反应物的转化率改变,平衡一定移动,D正确。答案选D。
2HI(g)混合体系加压,平衡不移动,但各组分的浓度都变大,混合气体的密度变大,正逆反应速率变大,所以A、B、C都是错误的;反应物的转化率改变,平衡一定移动,D正确。答案选D。
点评:不能用浓度、压强,密度等改变来判断平衡移动,而应该用转化率、体积分数的改变来判断平衡的移动。
本题难度:一般