微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 蛇纹石由MgO、A12O3、SiO2、Fe2O3组成。现取一份蛇纹石试样进行实验,首先将其溶于过量的盐酸,过滤后,得到沉淀X和滤液Y。下列叙述正确的是
A.沉淀X的成分是SiO2
B.从蛇纹石组成看,其成分皆是碱性氧化物
C.溶液Y中的阳离子主要是Mg2+、Al3+、Fe2+、H+
D.在溶液Y中加入过量的氨水,过滤得到的沉淀的成分是Fe(OH)3和Mg(OH)2
参考答案:A
本题解析:氧化物中SiO2为酸性氧化物,而A12O3为两性氧化物,排除B
加入过量盐酸后发生反应为:MgO+2H+=Mg2++H2O? Al2O3+6H+=2Al3++3H2O? Fe2O3+6H+=2Fe3++3H2O,SiO2不溶于盐酸,滤液Y的主要阳离子为:Mg2+、Al3+、Fe3+、H+,排除C,选项同A符合题意
溶液Y中加入过量的氨水,各金属离子均生成相应的沉淀,并且均不溶于弱碱,故D错误
答案为A
本题难度:一般
2、填空题 铝镁合金已成为飞机制造、化工生产等行业的重要材料.研究性学习小组的同学,为测定某含镁3%-5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究.填写下列空白.
【方案一】
将铝镁合金与足量NaOH溶液反应,测定剩余固体质量.实验中发生反应的化学方程式是______.
(1)称取5.4g铝镁合金粉末样品,溶于V?mL?2.0mol/L?NaOH溶液中.为使其反应完全,则NaOH溶液的体积V≥______.
(2)过滤、洗涤、干燥、称量固体.该步骤中若未洗涤固体,测得镁的质量分数将______(填“偏高”、“偏低”或“无影响”).
【方案二】
将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01×105Pa)的体积.
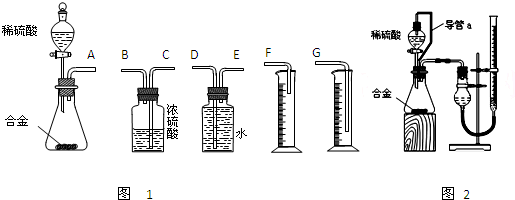
(1)同学们拟选用下列实验装置完成实验如图1:
①你认为最简易的装置其连接顺序是:A接______接______接______(填接口字母,可不填满.)
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶.请你帮助分析原因______.
③实验结束时,在读取测量实验中生成氢气的体积时,你认为合理的是______.
A.待实验装置冷却后再读数
B.上下移动量筒F,使其中液面与广口瓶中液面相平
C.上下移动量筒G,使其中液面与广口瓶中液面相平
D.视线与凹液面的最低点水平读取量筒中水的体积
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸?滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小.于是他们设计了图2所示的实验装置.
①装置中导管a的作用是______.
②实验前后碱式滴定管中液面读数分别为V1?mL、V2?mL.则产生氢气的体积为______mL.
参考答案:方案一:铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(1)含镁为3%时,金属铝的含量最高,5.4g合金中铝的质量为,5.4g×(1-3%)=5.4×97%g,则:
? 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
? 54g?2mol?
5.4g×97%g? ?V×10-3L×2.0mol/L
所以54g:(5.4g×97%g)=2mol:(V×10-3L×2.0mol/L),解得:V=97,故V(NaOH溶液)≥97mL;
故答案为:97mL;
(2)镁上会附着偏铝酸钠等物质,未洗涤导致测定的镁的质量偏大,镁的质量分数偏高;
故答案为:偏高;
方案二:(1)①装置的组装顺序:合金与水反应,用排水量气法测定氢气的体积,其中盛水的试剂瓶导管一定要短进长出,利用增大压强原理将水排出,量筒中水的体积就是生成氢气的体积,量筒内导管应伸入量筒底部,故连接顺序为:(A)接(E)(D)接(G);
故答案为:E、D、G;
②镁、铝与稀硫酸反应放热且生成气体,使锥形瓶中气体压强变大,导致硫酸不能顺利滴入锥形瓶;
故答案为:镁、铝与稀硫酸反应放热且生成气体,使锥形瓶中气体压强变大;
③反应放热导致氢气的温度偏高,故应冷却后再进行读取氢气的体积,读取实验中生成氢气的体积时上下移动量筒,使其中液面与广口瓶中液面相平,视线与凹液面的最低点水平读取氢气的体积;
故选ACD;
(2)①装置中导管a的作用是:保持分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下,滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差;
故答案为:保持分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下,滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差;
②滴定管的数值零刻度在上方,两次的体积之差为测定的氢气的体积,收集氢气后滴定管内液面读数减小,故测定氢气的体积为V1-V2;
故答案为:V1-V2.
本题解析:
本题难度:一般
3、选择题 下列实验过程中产生的现象与图中曲线变化相对应的是( )
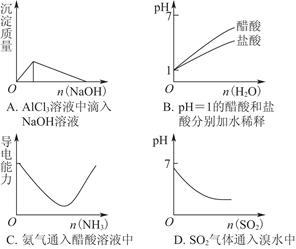
参考答案:D
本题解析:A项,沉淀Al3+和溶解沉淀需要的碱的物质的量之比为3∶1,错误;B项,醋酸为弱酸,稀释时促进醋酸的电离,所以稀释相同倍数后,醋酸的酸性强于盐酸,错误;C项,氨气通入醋酸溶液中,生成了醋酸铵,由弱电解质变成强电解质,酸性增强,错误;D项,SO2与溴水发生反应:SO2+Br2+2H2O=H2SO4+2HBr,生成了强酸,酸性增强,正确
本题难度:一般
4、选择题 对氧化铝的分类中正确的是
A.酸性氧化物
B.碱性氧化物
C.两性氧化物
D.不成盐氧化物(像CO一样)
参考答案:C
本题解析:由于氧化铝既能与酸反应产生盐和水,又能与碱反应产生盐和水,所以氧化铝属于两性氧化物。
本题难度:简单
5、选择题 100ml 1mol/L的AlCl3溶液与100ml? 3.5mol/L的NaOH溶液混合,得到沉淀为(?)
A.7.8g
B.0g
C.9.1 g
D.3.9g
参考答案:D
本题解析:AlCl3+3NaOH=Al(OH)3↓+3NaCl 0.1molAlCl3完全生成沉淀需要NaOH为0.3mol.从数据上看,氢氧化钠过量,多出的0.05molNaOH继续与0.1mol氢氧化铝反应,
Al(OH)3+NaOH=NaAlO2+2H2O 根据方程,0.05molNaOH消耗0.05mol氢氧化铝,剩余0.05mol氢氧化铝,质量为0.05×78=3.9g.正确选项是D.
本题难度:一般