微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一种新型镁铝合金的化学式为Mg17Al12,它具有储氢性能,该合金在一定条件下完全吸氢的化学方程式为:Mg17Al12+17H2=17MgH2+12Al,得到的混合物Y(17MgH2+12Al)在一定条件下能释放出氢气。下列说法正确的是
A.该合金的熔点介于金属镁和金属铝熔点之间
B.该合金中镁元素呈负价,铝元素呈正价
C.制备该合金应在氮气保护下,将一定比例的Mg、Al单质在一定温度下熔炼而获得
D.1mol Mg17Al12完全吸氢后得到的混合物Y与盐酸完全反应释放出H2,若消耗盐酸的体积为14L,则该盐酸的物质的量浓度为5mol.L-1
参考答案:C
本题解析:合金是指将两种或两种以上的金属(或金属跟非金属)熔合在一起而形成的具有金属特性的物质。A、合金的特性之一就是熔点比成分金属的低,错误;B、合金就是金属的混合,都为零价,错误;C、氮气与镁要发生反应,错误;D、1mol Mg17Al12完全相当于是17mol Mg与12mol Al混合。正确。
本题难度:一般
2、填空题 钠和铝是两种重要的金属。请回答:
(1)钠元素的金属性比铝的__________(填“强”或“弱”);常温下,可用________(填“钠”或“铝”)制成的容器盛装浓硫酸或浓硝酸。
(2)将一小块金属钠投入水中,发生反应的化学方程式为________________________;可观察到的实验现象是_____________(填序号)。
a.钠沉到水底 b.钠熔成小球 c.小球四处游动
(3)铝与氢氧化钠溶液反应的离子方程式为____________________________。
参考答案:(1)强;铝
(2)2Na+2H2O==2NaOH+H2↑;bc
(3)2Al+2OH-+2H2O==2AlO2-+3H2↑
本题解析:
本题难度:一般
3、计算题 回答如下几个问题
(1)近期发现不需要外加能源、节约水源而能除去废水中的卤代烷(有碍于人类健康)的方法:把铁放在含卤代烷的废水中,经一段时间后卤代烷“消失”。例如废水中的一氯乙烷经14.9d后就检不出来了。目前认为反应中卤代烷(RCH2X)是氧化剂。写出反应式并说明(按原子)得失电子的关系。
(2) 电解NaCl—KCl—AlCl3熔体制铝比电解Al2O3—Na3AlF6制铝节省电能约30%。为什么现仍用后一种方法制铝?
(3) NH4NO3热分解及和燃料油[以(CH2)n表示]反应的方程式及反应热分别为:
NH4NO3 = N2O + 2H2O + 0.53 kJ/g NH4NO3?…………(1)
NH4NO3 = N2 + 1/2 O2 + 2H2O + 1.47 kJ/g NH4NO3?………(2)
3n NH4NO3 + (CH2)n =" 3n" N2 + 7n H2O + n CO2
+ 4.29n kJ/g NH4NO3 ……(3)
试问:由以上三个热化学方程式可得出哪些新的热化学方程式?
(4) 参照水溶液化学反应的知识回答下面的问题:在液态BrF3中用KBrF4滴定Br2PbF10,过程中出现电导最低点。写出有关反应式。
参考答案:[解(1)] Fe+RCH2X+H+=Fe2++RH3+X—? (2分)
反应中1mol Fe失2mol电子,C得2mol电子。? (1分)
[解(2)]?主要是生产物无水AlCl3困难。制无水AlCl3的方法(反应式)
(1) ?2Al+3Cl2=2AlCl3
(2) ?Al2O3+3C+3Cl2=2AlCl3+3CO
若据(1)法制无水AlCl3,无意义(因用Al制成AlCl3再电解制Al)。
(2)法需Cl2,而制Cl2需电能。? (本小题总共4分)
[解(3)]? (2)式-(1)式? N2O = N2+ 1/2O2+0.94 kJ/g NH4NO3?
或41.4 kJ/mol? (2分)
这个热反应方程式是N2O分解热
(3)式-(2)式? (CH2)n + 3/2O2 = n CO2 + nH2O + 2.82 n kJ/moL
或676.8 n kJ/mol
这个热反应方程式是 (CH2)n的燃烧热。? (2分)
[解(4)]? 2KBrF4+(BrF2)2PbF6 = K2PbF6 + 4BrF3
(注:2BrF3 = BrF2+ + BrF4–?故KBrF4相当于水溶液体系中的KOH
(BrF2)2PbF6相当于水体系中的质子酸)? (4分)
本题解析:[试题分析与解题思路(1)]本题由四个小题组成,因而得分点较多。第一小题题面明确提到卤代烷可以跟金属铁起反应,反应中卤代烷是氧化剂,没有说的是卤代烷变什么和铁变什么。由于该反应对学生是很陌生的,是无机与有机的结合点,看似简单实在不易。但在实际面对铁与卤代烃的反应方程式时,猜出卤代烃被还原是生成烃而铁被氧化是生成二价铁是不难的。氢原子不足了,因而反应物里应添氢离子(质子)。这个试题猜测的成分较高,信息量过少。卤代烃被还原究竟得到什么烃?答案给出的是最简单的情况。写其他烃也不能说就答错了。但无论如何卤代烃里的氯反应后应当变成 氯离子而不会是氯气之类,否则有悖题意(卤代烃被还原)。
[解(1)] Fe+RCH2X+H+=Fe2++RH3+X—? (2分)
反应中1mol Fe失2mol电子,C得2mol电子。? (1分)
[评注] 应试结果此题得分率很高。区分度不大。
[试题分析与解题思路(2)]学生在解第二小题时可能会觉得不知题面给的信息意味着什么而束手无策。这是在考察学生的实际观念。如果想到用AlCl3电解制铝省电而不用,可能是因为制备AlCl3仍然要用电,就上了正道。制备一种有用的化学品必定要考虑原料来源,这是制备反应的一般原则。
[解(2)]?主要是生产物无水AlCl3困难。制无水AlCl3的方法(反应式)
(3) ?2Al+3Cl2=2AlCl3
(4) ?Al2O3+3C+3Cl2=2AlCl3+3CO
若据(1)法制无水AlCl3,无意义(因用Al制成AlCl3再电解制Al)。
(3)法需Cl2,而制Cl2需电能。? (本小题总共4分)
[注]此题的应答可能与标准答案的表述不同,但只要说到点子上都可得分。
[评注] 应答结果,大多数学生答不出来。因为学生没有从原料的来源上考虑问题。这就是说,命题人的测试切中要害,我们现在的中学教学在联系实际的理解上可能有些问题。
[试题分析与解题思路(3)]第三小题需要反复思考题面给出的三个反应的可能组合才会找到答案。这个试题是热化学定律的灵活运用。思考容量大,但最后得到的结果是唯一的。
[解(3)]? (2)式-(1)式? N2O = N2+ 1/2O2+0.94 kJ/g NH4NO3?
或41.4 kJ/mol? (2分)
这个热反应方程式是N2O分解热
(4)式-(2)式? (CH2)n + 3/2O2 = n CO2 + nH2O + 2.82 n kJ/moL
或676.8 n kJ/mol
这个热反应方程式是 (CH2)n的燃烧热。? (2分)
[试题分析与解题思路(4)]第四小题的信息分析是很难的,只有想象力丰富的学生才可能答得上来。如果学生想到滴定反应电导降低意味着产物的离子总数比反应物离子总数少,就应将水溶液的中和反应迁移到这种以BrF3为溶剂的新情景中来,想到这个滴定反应一定是生成了溶剂分子,于是就会想到题面给出的Br2PbF10可以看成是BrF2+与PbF62–的结合物,这样,问题就得解了。
[解(4)]? 2KBrF4+(BrF2)2PbF6 = K2PbF6 + 4BrF3
(注:2BrF3 = BrF2+ + BrF4–?故KBrF4相当于水溶液体系中的KOH
(BrF2)2PbF6相当于水体系中的质子酸)? (4分)
[评注] 此小题应答结果表明,这样生疏的命题大多数学生不知道从哪里想起,答不上来。
本题难度:一般
4、选择题 现有AlCl3和MgSO4混合溶液,向其中不断加入KOH溶液,得到沉淀的量与加入KOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为
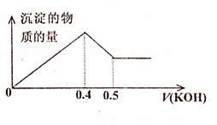
A.1:3
B.2:3
C.3:1
D.6:1
参考答案:D
本题解析:略
本题难度:一般
5、选择题 某氧化物X难溶于水,能与烧碱反应,生成易溶于水的化合物Y,将少量Y溶液滴入盐酸中无沉淀生成,则X是? ( )。
A.SiO2
B.Al2O3
C.MgO
D.CuO
参考答案:B
本题解析:C项MgO不能溶于烧碱,不正确;少量Y滴入盐酸不能形成沉淀,Al2O3符合题意,A项不正确;B项正确;D项CuO不能溶于烧碱,不正确。
本题难度:一般