微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。
己知:2KMnO4+16HCl=2KCl+5Cl2↑+2MnCl2+8H2O
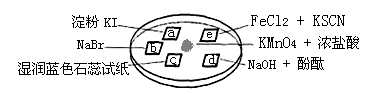
对实验现象的“解释或结论”正确的是
选项
| 实验现象
| 解释或结论
|
A
| a处变蓝,b处变红棕色
| 氧化性:Cl2>Br2>I2
|
B
| c处先变红,后褪色
| 氯气与水生成了酸性物质
|
C
| d处立即褪色
| 氯气与水生成了漂白性物质
|
D
| e处变红色
| 氧化性:Cl2 > Fe3+
|
?
参考答案:D
本题解析:KMnO4与浓盐酸发生反应产生氯气,A.在a处发生反应:Cl2+2KI=2KCl+I2. I2遇淀粉会变为蓝色。在b处发生反应:Cl2+2NaBr=2NaCl+Br2。这只能证明氧化性Cl2>Br2;Cl2> I2。但是不能证明Br2>I2。错误。B. 在c处发生反应Cl2+H2O HCl+HClO,HCl是酸,电离产生H+使溶液显酸性,能使湿润的蓝色石蕊试纸变红,由于还产生了有强氧化性的HClO,它能把有色物质氧化为无色物质,所以后来又褪色。错误。C.在d处发生反应:Cl2+2NaOH=NaCl+NaClO+H2O。由于碱被消耗,溶液的碱性减弱,所以酚酞的红色逐渐变浅。错误。D.在e处发生反应:2Fe2++Cl2= 2Cl-+2Fe3+;Fe3++ 3SCN-=Fe(SCN)3.溶液变为血红色。证明了氧化性Cl2 > Fe3+。正确。
HCl+HClO,HCl是酸,电离产生H+使溶液显酸性,能使湿润的蓝色石蕊试纸变红,由于还产生了有强氧化性的HClO,它能把有色物质氧化为无色物质,所以后来又褪色。错误。C.在d处发生反应:Cl2+2NaOH=NaCl+NaClO+H2O。由于碱被消耗,溶液的碱性减弱,所以酚酞的红色逐渐变浅。错误。D.在e处发生反应:2Fe2++Cl2= 2Cl-+2Fe3+;Fe3++ 3SCN-=Fe(SCN)3.溶液变为血红色。证明了氧化性Cl2 > Fe3+。正确。
本题难度:一般
2、选择题 实验室制取氯气后,剩余的尾气用下列哪种方法处理最好
A.用浓硫酸吸收
B.用自来水吸收
C.用生石灰吸收
D.用氢氧化钠溶液吸收
参考答案:D
本题解析:浓硫酸不能吸收氯气,自来水吸收不充分,生石灰是固体不不易吸收氯气,氯气与氢氧化钠溶液反应可以充分的吸收氯气,所以答案选D。
本题难度:一般
3、填空题 Na与Cl2反应(点燃):____________________________
参考答案: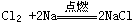
本题解析:
本题难度:简单
4、选择题 下列现象与解释合理的是( )
A.光照氯水时有气泡逸出,是因为次氯酸分解产生Cl2
B.H2O2被称为绿色环保氧化剂,是因为它的还原产物是O2
C.蔗糖中加入浓硫酸后变黑,是因为浓硫酸有脱水性
D.室温下可用铝槽车装运浓硫酸,是因为常温浓硫酸与铝不反应
参考答案:A.光照氯水时有气泡逸出,是因为次氯酸分解生成氧气,故A错误;
B.氧化剂被还原,元素的化合价降低,则H2O2被称为绿色环保氧化剂,是因为它的还原产物是水,故B错误;
C.浓硫酸具有脱水性,则蔗糖中加入浓硫酸后、H、O元素以水的形式脱出,只剩下C元素,则变黑,故C正确;
D.钝化发生了氧化还原反应,生成致密的氧化物阻止反应的进一步发生,则室温下可用铝槽车装运浓硫酸,故D错误;
故选C.
本题解析:
本题难度:简单
5、选择题 下列化学实验事实及其结论都正确的是(?)
选项
| 实验事实
| 结论
|
A
| 将SO2通入含HClO的溶液中生成H2SO4
| HClO的酸性比H2SO4强
|
B
| 铝箔在酒精灯火焰上加热熔化但不滴落
| 铝箔表面氧化铝熔点高于铝
|
C
| 稀、浓硝酸分别与铜反应,还原产物分别为NO和NO2
| 稀硝酸氧化性比浓硝酸强
|
D
| 将SO2通入溴水中,溴水褪色
| SO2具有漂白性
参考答案:B
本题解析:A.将SO2通入含HClO的溶液中生成H2SO4, 是因为HClO的氧化性比H2SO4强,能够把SO2氧化为H2SO4。错误。B.铝箔在酒精灯火焰上加热熔化但不滴落,是由于加热时在金属表面产生了熔点高于铝的氧化铝,包裹在熔化的Al的外边,是其不至于滴落。正确。C.稀、浓硝酸分别与铜反应,还原产物分别为NO和NO2,是浓硝酸氧化性比稀硝酸强,它把NO又氧化为NO2。错误。D.将SO2通入溴水中,溴水褪色,是由于发生反应Br2+2H2O+SO2= SO42-+4H++2Br-,这是SO2的还原性。错误。
本题难度:简单
|