微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 在烧杯中盛有半杯的B 91eXaM.orga(OH)2溶液,然后用滴管向烧杯中滴加H2SO4(装置如右图)。随着硫酸的滴入,电灯会逐渐变暗,当两者恰好完全反应时,电灯完全熄灭。
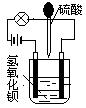
(1)该实验说明溶液的导电性与_________________有关。
(2)上述反应的离子方程式为_________________________________________。
(3)可以利用上述原理进行溶液浓度的测定。若烧杯中装有75mL 0.1mol/L Ba(OH)2溶液,当滴入25mL H2SO4时,电灯完全熄灭。试求该硫酸溶液的物质的量浓度。
(4)若用98%、1.84g/mL的浓硫酸配制上述浓度的硫酸溶液2500mL,需要多少毫升的浓硫酸(精确到0.1mL)。
参考答案:(1)离子浓度(2分)
(2)Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O(3分)
(3)0.3mol/L(5分)
(4)40.8mL(4分)
本题解析:向稀硫酸溶液中慢慢滴加氢氧化钡溶液直至过量,由于发生了反应:Ba(OH)2 +H2SO4═BaSO4↓+2H2O,随着氢氧化钡溶液的滴加,离子浓度逐渐减小,导电性逐渐降低,最后导电能力为零,也就是说恰好完全反应时没有自由移动的离子了,所加物质过量就又能够导电了,溶液中溶液的导电性变化是强→弱(水有微弱的导电性)→强。
⑴该实验说明溶液的导电性与离子浓度有关,答案:离子浓度;⑵上述反应的离子方程式为:Ba2++2OH-+2H++SO42-==BaSO4↓+2H2O,答案:Ba2++2OH-+2H++SO42-==BaSO4↓+2H2O;⑶电灯完全熄灭,说明反应刚好完全进行,由方程式可知:
Ba(OH)2? +? H2SO4═BaSO4↓+2H2O
1?1
75mL×0.1mol/L? C×25mL
75mL×0.1mol/L=C×25mL
C=0.3mol/L
答案:0.3mol/L;
⑷若用98%、1.84g/L的浓硫酸配制上述浓度的硫酸溶液2500mL:浓H2SO4的物质的量浓度c=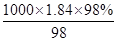 mol·L-1=18.4mol·L-1,根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,设浓硫酸的体积为xmL,所以xmL×18.4mol·L-1=2500mL×0.3mol·L-1,解得:x≈40.8,所以应量取的浓硫酸体积是40.8mL,答案:40.8mL.
mol·L-1=18.4mol·L-1,根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,设浓硫酸的体积为xmL,所以xmL×18.4mol·L-1=2500mL×0.3mol·L-1,解得:x≈40.8,所以应量取的浓硫酸体积是40.8mL,答案:40.8mL.
本题难度:一般
2、简答题 下列有关溶液中微粒浓度关系的叙述正确的是( )
A.c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)>c[(NH4)2SO4]>c(NH4Cl)
B.已知HF的酸性比CH3COOH强,pH相等的NaF与CH3COOK溶液中,[c(Na+)-c(F-)]<[c(K+)-c(CH3COO-)]
C.等物质的量浓度Na2CO3溶液和NaHCO3溶液等体积混合,所得溶液中:c(CO32-)+2c(OH-)=2c(H+)+c(HCO3-)+3c(H2CO3)
D.溶有等物质的量NaClO、NaHCO3的溶液中:c(HClO)+2c(C1O-)=c(HCO3-)+c(H2CO3)+c(CO32-)
参考答案:A.等浓度的(NH4)2SO4溶液,NH4HSO4溶液和NH4Cl溶液,由水解可知c(NH4+)的关系为c[(NH4)2SO4]>c[NH4HSO4]>c(NH4Cl),则c(NH4+)相等时,三种盐溶液的浓度关系为c[(NH4)2SO4]<c[NH4HSO4]<c(NH4Cl),故A错误;
B.pH相等,则两溶液中c(H+)、c(OH-)相等,NaF溶液中存在c(Na+)+c(H+)=c(F-)+c(OH-),CH3COOK溶液中存在c(K+)+c(H+)=c(CH3COO-)+c(OH-),则有[c(Na+)-c(F-)]=[c(K+)-c(CH3COO-)]=[c(OH-)-c(H+)],故B错误;
C.等物质的量浓度Na2CO3溶液和NaHCO3溶液等体积混合中存在电荷守恒:2c(CO32-)+c(OH-)+c(HCO3-)=c(Na+)+c(H+),根据物料守恒可知存在2c(Na+)=3c(HCO3-)+3c(H2CO3)+3c(CO32-),二者联式可得c(CO32-)+2c(OH-)=2c(H+)+c(HCO3-)+3c(H2CO3),故C正确;
D.溶有等物质的量NaClO、NaHCO3的溶液中存在物料守恒,应为c(HClO)+c(C1O-)=c(HCO3-)+c(H2CO3)+c(CO32-)=12c(Na+),故D错误.
故选C.
本题解析:
本题难度:一般
3、选择题 下列叙述中,正确的是
[? ]
A.0.1mol/L CH3COOH溶液加水稀释时,所有离子的浓度都减小
B.NH4Cl溶液显酸性的原因:NH4++H2O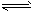 NH3·H2O+H+
NH3·H2O+H+
C.0.2mol/L盐酸与等体积0.05mol/L Ba(OH)2溶液混合后,溶液pH为1
D.25℃时pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7
参考答案:B
本题解析:
本题难度:一般
4、选择题 常温下,有c(CH3COOH)+c(CH3COO-)=0.1mol?L-1的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示.下列有关离子浓度关系叙述正确的是?( )

A.pH=5.5溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B.W点表示溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)+c(CH3COOH)
C.pH=3.5溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1?mol?L-1
D.向W点所表示溶液中通入0.05molHCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-)
参考答案:A.pH=5.5比4.75大,W点时c(CH3COOH)=c(CH3COO-),从曲线来看当pH=5.5时,c(CH3COOH)<c(CH3COO-),故A错误;
B.溶液存在电荷守恒,应为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故B错误;
C.pH=3.5溶液中c(Na+)+c(H+)=c(CH3COO-)+c(OH-),再把题干中的c(CH3COOH)+c(CH3COO-)=0.1mol?L-1代入即可得c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1?mol?L-1,故C正确;
D.向W点所表示溶液中通入0.05molHCl气体,原有平衡被打破,建立起了新的平衡,溶液中电荷守恒关系为:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)+c(Cl-);物料守恒关系为:2c(Na+)=c(CH3COO-)+c(CH3COOH)=0.1mol?L-1,不可能得出上述结论,故D错误.
故选C.
本题解析:
本题难度:一般
5、选择题 下列物质中属于非电解质的是( )
A.氯化钾的水溶液
B.液态氯化氢
C.气态甲烷
D.作电极的碳棒
参考答案:A.氯化钾的水溶液,是混合物,既不是电解质,也不是非电解质,故A错误;
B.液态氯化氢,是纯净物,氯化氢水溶液能导电,是由于电离出自由移动的氢离子和氯离子,氯化氢是化合物,属于电解质,故B错误;
C.气态甲烷,甲烷难溶于水,水溶液中和熔融状态下都不能够导电,是非电解质,故C正确;
D.作电极的碳棒是单质,不是化合物,所以不是电解质,也不是非电解质,故D错误;
故选C.
本题解析:
本题难度:一般