| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学必备知识点《水的电离平衡》试题强化练习(2017年最新版)(四)
参考答案:BD 本题解析:A.电解质的强弱一溶解度的大小无关,因此强电解质不一定易溶于水,错误;B.钢铁在海水中发生的电化腐蚀是吸氧腐蚀,铁作负极,失去电子,被氧化,错误;C.对可逆反应,升高温度,化学平衡向吸热反应方向移动,但是吸热反应不一定是正反应,所以不一定存在v(正)>v(逆) ,错误;D.相同浓度时,由于强酸电离产生的H+浓度大于弱酸,因此对水电离的抑制作用也大于弱酸,故强酸中水的电离程度比弱酸的水的电离程度小,正确。 本题难度:简单 2、填空题 下表是不同温度下水的离子积数据 参考答案:(1)>;理由是:温度升高,水的电离程度增大,离子积增加 本题解析: 本题难度:一般 3、选择题 关于浓度相等的三种溶液:①H2CO3;②NaOH;③Na2CO3溶液,下列说法正确的是: |
参考答案:AC
本题解析:A、NaOH为强碱、H2CO3为弱酸,抑制水的电离,浓度相等的NaOH溶液对水的电离抑制程度更大,Na2CO3水解,促进水的电离,所以水电离出的c(H+):③>①>②,正确;B、NaOH为强碱,pH最大,Na2CO3水解显碱性,pH其次,H2CO3为弱酸,pH最小,所以溶液的pH:②>③>①,错误;C、①和②等体积混合后为NaHCO3溶液,根据物料守恒可得:c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-),正确;D、①和③等体积混合后,根据电荷守恒可得:c(Na+)+ c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),错误。
考点:本题考查水的电离、平衡的判断、物料守恒和电荷守恒。
本题难度:困难
4、选择题 在常温下,将pH=8的NaOH溶液与pH=10的NaOH溶液等体积混合后,溶液的pH最接近于:
A.8.3
B.8.7
C.9
D.9.7
参考答案:D
本题解析: 将pH=8的NaOH与pH=10的NaOH溶液等体积混合后,溶液中OH-的浓度是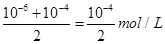 ,则根据水的离子积常数可知c(H+)=
,则根据水的离子积常数可知c(H+)=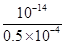 =2×10-10 mol/L,根据pH计算公式计算等pH为9.7.答案选D。
=2×10-10 mol/L,根据pH计算公式计算等pH为9.7.答案选D。
考点:考查强间混合时氢离子浓度的有关计算
本题难度:一般
5、选择题 下列叙述正确的是( )
A.90℃纯水的pH<7,说明加热可导致水呈酸性
B.将稀氨水逐滴加入稀盐酸中,当溶液的pH=7时,c(Cl-)>c(NH4+)
C.在KI溶液中加入AgCl固体,溶液中c(I-)下降
D.pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7
参考答案:C
本题解析:
本题难度:一般
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:高考化学知识点整理《能量的相互.. | ||