微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (本题共15分)二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟有左下图所示的装置模拟制取并收集ClO2。
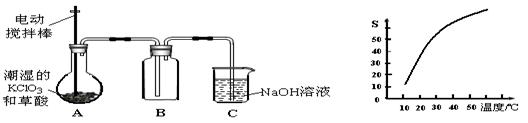
(1)B必须放在冰水浴中控制温度,其原因是 ;
(2)反应后在装置C中可得NaClO2溶液。已知NaClO2饱和溶液中在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。根据右上图所示的NaClO2的溶解度曲线,请补充从NaClO2溶液中制得NaClO2的操作步骤:
a ;b ;③洗涤;④干燥。
(3)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100.00 mL试样;量取V1 mL试样加入到锥形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入淀粉指示剂,用c mol·L—1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。
(已知2 Na2S2O3 + I2 →Na2S4O6 + 2NaI)
①配制70 mL c mol/LNa2S2O3标准溶液时,用到的玻璃仪器除烧杯、量筒、玻璃棒外还有: 。
②步骤2中发生反应的离子方程式为: 。
③判断滴定终点的现象 。
原ClO2溶液的浓度为 g / L(用步骤中的字母代数式表示)。
④若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果 ;若滴定开始仰视读数,滴定终点时正确读数,则测定结果 。(填 “偏高”“偏低”或“不变”)
参考答案:(1)使ClO2充分冷凝,减少挥发(2分) (2)a .蒸发结晶 b. 趁热过滤 (各1分)
(3)①100ml 容量瓶、胶头滴管(各1分)②2ClO2+8H++10I-=Cl2+5I2+4H2O(2分)
③加到最后一滴时,溶液的颜色恰好由蓝色变为无色,且半分钟不变化(2分) 135cV2/V1(3分)
④偏高 偏低(各1分)
本题解析:(1)二氧化氯的熔点较低,为收集二氧化氯,应在较低温度下进行,所以应该采用冰水浴,故答案为:使ClO2充分冷凝,减少挥发;
(2)从溶液中析出溶质,一般采用蒸发结晶、过滤、洗涤、干燥的方法,在温度高于38℃时析出晶体是NaClO2,所以为防止析出晶体NaClO2?3H2O需要趁热过滤,故答案为:蒸发结晶、趁热过滤;
(3)①配制70mL c mol?L-1 Na2S2O3标准溶液时,应选择100mL容量瓶和胶头滴管;故答案为:100mL 容量瓶、胶头滴管;
②二氧化氯检验氧化性,能把碘化钾氧化生成单质碘,自身被还原为氯气,反应的方程式为2ClO2+8H++10I-=Cl2+5I2+4H2O;
③由于碘遇淀粉显蓝色,所以终点的实验现象是加到最后一滴时,溶液的颜色恰好由蓝色变为无色,且半分钟不变化;设原ClO2溶液的浓度为x,则
2ClO2~5I2~~~~~~~~~~10Na2S2O3
2mol 10mol
(10-2x×V1×10-3)÷0.1 mol 1×10-3cV2mol
解得x=135cV2/V1g?L-1;
④把空气的体积算在内,故读出的消耗的体积就偏大,故测定结果偏高;若滴定开始仰视读数,则读数偏大。滴定终点时正确读数,则测定结果偏低。
考点:考查物质制备、含量测定实验方案的设计
本题难度:困难
2、填空题 25℃时,某酸HA:Ka=1.0×10-7,已知:溶液的酸度AG=lg[c(H+)/c(OH-)]
(1)HA的电离方程式为 。
(2)0.1 mol·L-1HA溶液中,c(H+)= ,AG= 。
(3)保持25℃,下列方法能使HA溶液的电离度、溶液pH都增大的是 (填字母)
A.加水稀释 B.加少量盐NaA固体 C.加少量NaOH固体
参考答案:(1)HA H++A- (2)10-4mol/L 6 (3)A C
H++A- (2)10-4mol/L 6 (3)A C
本题解析:
试题分析:(1)由电离平衡常数可知HA为弱酸。所以HA的电离方程式为HA H++A-。(2)
H++A-。(2)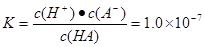 ,由于c(HA)=0. 1 mol/LHA溶液中,解得c(H+)=10-4mol/L。c(OH-)=10-10mol/L,所以AG=6.(3)保持25℃,A.加水稀释HA溶液的电离度增大,由于c(H+)减小,所以溶液pH增大。正确。B.加少量盐NaA固体,电离平衡HA
,由于c(HA)=0. 1 mol/LHA溶液中,解得c(H+)=10-4mol/L。c(OH-)=10-10mol/L,所以AG=6.(3)保持25℃,A.加水稀释HA溶液的电离度增大,由于c(H+)减小,所以溶液pH增大。正确。B.加少量盐NaA固体,电离平衡HA H++A-逆向移动,HA溶液的电离度减小,c(H+)减小,溶液pH增大。错误。C.加少量NaOH固体,电离平衡HA
H++A-逆向移动,HA溶液的电离度减小,c(H+)减小,溶液pH增大。错误。C.加少量NaOH固体,电离平衡HA H++A-正向移动,HA溶液的电离度增大,由于不断消耗H+,所以c(H+)减小,溶液pH增大。正确。考点:考查弱电解质的电离方程式的书写、c(H+)与AG的关系、外界条件对电离平衡的影响的知识。
H++A-正向移动,HA溶液的电离度增大,由于不断消耗H+,所以c(H+)减小,溶液pH增大。正确。考点:考查弱电解质的电离方程式的书写、c(H+)与AG的关系、外界条件对电离平衡的影响的知识。
本题难度:一般
3、填空题 某温度下,纯水的c(H+) =2.0×10-7 mol/L,则此时c( OH -)=___,KW=____,温度不变,向水中滴入盐酸,使c(H+)=5.0×10-5 mol/L.则c(OH-)= __________。
参考答案:2.0×10 -7 mol/L ;4.0×10 -14? ;8 .0×10 -10 mol.·L-1
本题解析:
本题难度:一般
4、选择题 常温时,在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH- 离子浓度分别为Amol/L与Bmol/L,则A和B关系为 ( )
A.A>B
B.A=10-4 B
C.B=10-4 A
D.A=B