| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学必备知识点《原电池原理》试题巩固(2017年最新版)(六)
参考答案:D 本题解析:锌片是负极铜片是正极,当导线中有0.2 mol电子通过时,负极消耗的锌片6.5 g 本题难度:一般 3、填空题 (10分)磺酰氯(SO2Cl2)是一种有机氯化剂,也是锂电池正极活性物质。已知磺酰氯是一种无色液体,熔点-54.1℃,沸点69.1℃,遇水发生剧烈水解。 参考答案:(10分,每空2分)(1)2 (2)①MnO2 + 4HCl(浓) 本题解析:(1)根据方程式可知 P元素化合价从0价升高到+5价,失去5个电子。S元素化合价从+6价降低到+4价,所以若生成1molSO2,转移电子的物质的量为2mol。 本题难度:困难 4、选择题 关于如图所示的装置的叙述,正确的是( ) |
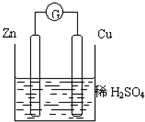
参考答案:A、该原电池中锌作负极,铜作正极,所以电子从负极锌沿导线流向正极铜,电流流向与电子流向相反,即电流从铜片经导线流向锌片,故A错误.
B、负极上锌失电子生成锌离子进入溶液,正极上氢离子得电子生成氢气,硫酸根离子没有析出所以浓度不变,故B错误.
C、负极上锌失电子生成锌离子进入溶液,所以锌质量减少;正极铜上氢离子得电子生成氢气,故C正确.
D、正极上氢离子得电子生成氢气,所以导致溶液中氢离子浓度降低,溶液的PH值增大,故D错误.
故选C.
本题解析:
本题难度:一般
5、选择题 下列有关说法正确的是
A.反应CO2(g)+C(s)=2CO(g)在高温下可自发进行,则该反应的△H> 0
B.工业上电解饱和食盐水时,以石墨作阴极,铁棒作阳极
C.常温下,0.1mol·L-1 CH3COOH溶液pH=1
D.常温下,在AgCl悬浊液中加入少量NaCl饱和溶液,c(Ag+)减小,Ksp(AgCl) 减小
参考答案:A
本题解析:A.反应CO2(g)+C(s)=2CO(g)△H> 0,△S> 0故在高温下可自发进行,正确;B.工业上电解饱和食盐水时,以石墨作阴极,铁棒作阳极时会发生反应产生二价铁离子,错误;C.CH3COOH是弱酸不能完全电离,常温下,0.1mol·L-1 CH3COOH溶液pH大于1,错误;D.Ksp(AgCl) 只与温度有关,温度不变其值也不会改变,错误;正确答案为A。
本题难度:一般
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:高中化学必备知识点《水的电离平.. | ||