微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 实验室配制FeSO4溶液通常需要加入少量稀硫酸与铁屑。完成下列填空:
(1)加入铁屑的目的是:__________;加入稀硫酸的目的是:________。
(2)有一瓶未加稀硫酸与铁屑的FeSO4溶液,在空气中放置一段时间后,溶液颜色变黄且有红褐色浑浊。写出并配平上述变化的化学反应方程式:

(3)上述反应中的还原产物是:_______________。
(4)现有1.2L含3mol FeSO4的溶液恰好与0.6 mol HIO3完全反应,则还原产物是________。如果改用
HBrO3恰好与上述FeSO4的溶液反应,则最少消耗的HBrO3______0.6 mol。(填“大于”、“小于”或“等于”)理由是________________。
参考答案:(1)防止FeSO4被氧化;防止FeSO4水解。
(2)12FeSO4+3O2+6H2O==4Fe2(SO4)3+4Fe(OH)3↓
(3)Fe(OH)3?
(4)I2;小于;HBrO3的还原产物是HBr而HIO3的还原产物是I2
本题解析:
本题难度:一般
2、选择题 当向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,烧杯底部不可能出现的情况是( )
A.有铜无铁
B.有铁无铜
C.有铁有铜
D.无铁无铜
参考答案:B
本题解析:
本题难度:一般
3、简答题 为了除去FeSO4溶液中少量的Fe2(SO4)3和CuSO4杂质,可选用的试剂是( )
A.Fe
B.氨水
C.NaOH
D.氯水
参考答案:除杂的条件:①能够除去杂质;②不能带入新的杂质;③不能与被提纯物质发生反应.
A、金属铁可以和硫酸铁生成硫酸亚铁,和硫酸铜生成金属铜和硫酸亚铁,将溶液过滤即可,因此符合除杂的条件,故A正确;
B、氨水会和硫酸亚铁发生反应,故不符合条件,故B错误;
C、氢氧化钠会和硫酸亚铁发生反应,故不符合条件,故C错误;
D、氯水能将亚铁离子氧化为三价,因此不符合条件,故D错误.
故选A.来源:91考试网 91eXAm.org
本题解析:
本题难度:一般
4、选择题 X、Y、Z、W有如图所示的转化关系,且△H=△H1+△H2,则X、Y可能是
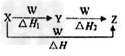
[? ]
①C、CO ②S、SO2 ③AlCl3、Al(OH)3 ④Na2CO3、NaHCO3 ⑤Fe、FeCl2
A.①②③④⑤
B.②④⑤
C.①③④?
D.①②③
参考答案:C
本题解析:
本题难度:一般
5、简答题 在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下,请回答下列问题:
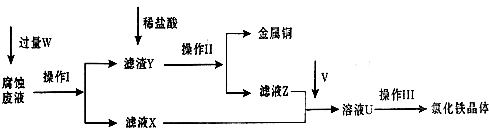
(1)请写出FeCl3溶液与铜反应的离子方程式:______;操作Ⅰ加入的试剂W是______.
(2)操作Ⅱ之前最好加入适量稀盐酸,某同学用10mol-L-1?的浓盐酸配制250mL?1mol-L-1?的稀盐酸,并进行有关实验.
①需要量取浓盐酸______mL.
②配制该稀盐酸时除量筒、烧杯、玻璃棒外,还必须用到的仪器有______、______.
③用已知浓度的氢氧化钠溶液滴定稀盐酸,滴定过程中眼睛应注视______,实验时未用标准液润洗滴定管,测得锥形瓶中待测液的浓度______实际浓度.(填“>”、“<”或“=”).
(3)操作Ⅲ前需要通入气体V,请写出实验室制取气体V的化学方程式:______,该反应中______是氧化剂.
(4)操作Ⅲ应在HCl气流氛围中进行,其原因是______.
(5)若通入的V的量不足,则最后制得的氯化铁晶体不纯净,这是因为溶液U中含有杂质______.请设计合理的实验,验证溶液U中的成分,并判断通入的V的量是否不足______(简要说明实验步骤、现象和结论).
供选择的试剂:酸性KMnO4溶液、KSCN溶液、氯水.
(6)若向氯化铁溶液中加入一定量石灰水,调节溶液pH,可得红褐色沉淀.该过程中调节溶液的pH为5,则金属离子浓度为______.(己知:Ksp[Fe(OH)3]=4.0×10-38)
参考答案:(1)FeCl3溶液与铜反应的离子方程式为:2Fe3++Cu═2Fe2++Cu2+,金属铁可以讲金属铜从其盐中置换出来,所以加的W是铁粉或Fe,故答案为:2Fe3++Cu═2Fe2++Cu2+;铁粉或Fe;
(2)①用10mol?L-1?的浓盐酸配制250mL?1mol?L-1?的稀盐酸,稀释前后溶质的物质的量不变,这所需浓盐酸的体积是V,则V?10mol?L-1=250mL?1mol?L-1,解得V=25mL,故答案为:25mL;
②配制一定物质的量浓度的溶液所需的玻璃仪器有:量筒、烧杯、玻璃棒、250mL容量瓶、胶头滴管,故答案为:250mL容量瓶、胶头滴管;
③用已知浓度的氢氧化钠溶液滴定稀盐酸,滴定过程中眼睛应注视锥形瓶内溶液颜色的变化,未用标准液润洗滴定管,相当于将标准液稀释,所需标准液的体积增多,所以测得锥形瓶中待测液的浓度大于实际浓度,故答案为:锥形瓶内溶液颜色的变化;大于;
(3)实验室制氯气的化学方程式为:MnO2+4HCl(浓)?△?.?MnCl2+Cl2↑+2H2O,izhongMn的化合价降低,所以二氧化锰是氧化剂,故答案为:MnO2+4HCl(浓)?△?.?MnCl2+Cl2↑+2H2O;MnO2;
(4)三价铁离子易水解,氯化铁溶液蒸干得不到氯化铁晶体,所以需要加入酸来抑制铁离子水解,故答案为:抑制Fe3+(或FeCl3)的水解;
(5)若通入的氯气的量不足,亚铁离子不会完全被氧化为三价铁离子,所以最后制得的氯化铁晶体不纯净,会含有氯化亚铁,亚铁离子具有还原性,可以是高锰酸钾褪色,三价铁离子能使硫氰酸钾变为红色,可以据此来检验,
故答案为:FeCl2或Fe2+,;取少量溶液U,加入几滴KSCN溶液,溶液显红色,则表明溶液U中有Fe3+(FeCl3);另取少量溶液U,加入几滴酸性KMnO4溶液,若KMnO4溶液退色,则表明溶液U中有Fe2+(或FeCl2),说明通入的氯气的量不足够,若KMnO4溶液不退色,则说明通入的氯气的量充足;
(6)根据氢氧化铁的Ksp表达式:Ksp=[Fe3+][[OH-]3],溶液的pH为5即[H+]=10-5mol/L,所以金属铁离子浓度为4.0×10-11?mol?L-1,故答案为:4.0×10-11mol?L-1.
本题解析:
本题难度:一般