微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列关于实验现象的描述正确的是?(?)
A.形成原电池后,原电池中的阳离子移向负极
B.铜锌原电池的正极是锌,电解质溶液可以是稀硫酸
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
参考答案:D
本题解析:在原电池中电子通过导线传递到正极上,所以溶液中的阳离子向正极移动。锌比铜,锌应该作负极。铁比铜活泼,因此铜不可能把铁置换出来,但铜可以把铁离子还原生成氩铁离子。在选项D中可以构成铜锌原电池,从而加快反应速率。答案是D。
本题难度:简单
2、填空题 请判断下图所示的装置中,A、B、C各是什么池。
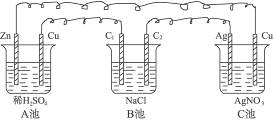
A_____________________________________;
B_____________________________________;
C_____________________________________。
参考答案:原电池?电解池?电镀池
本题解析:由图可知B池是电解池。A池、C池中若两极各自单独相连时都可形成原电池。两极的金属活动性相差越大,所形成的原电池的电动势也就越大。于是,我们可得出CuZn原电池的电动势大于AgCu原电池的电动势的结论。若A池与C池相连时,A为原电池、C为电解池。又C池中的阳极材料为Ag,电解质溶液为AgNO3溶液,故C池是一个电镀池,是在Cu上镀银。A池中Zn为负极,Cu为正极;B池中C1为阳极、C2为阴极;C池中Ag为阳极,Cu为阴极。即这个装置是用一个原电池串联着一个电解池和一个电镀池。
本题难度:简单
3、填空题 有甲、乙、丙、丁四种液体,它们分别为Fe(OH)3胶体、硅酸胶体、As2S3胶体、NaOH溶液.现将有关实验现象记录如下:(1)电泳:甲液体的阳极周围颜色变浅,阴极周围颜色变深;(2)将一束光通过乙液体,无丁达尔现象;(3)将乙慢慢加入到丙液中,先出现凝聚,后液体变清,则甲为 ,乙为 ,丙为 ,丁为 。
参考答案:Fe(OH)3胶体;NaOH溶液;硅酸胶体;As2S3胶体。
本题解析:据(1),甲液体中的胶体微粒应带正电荷,甲液体为Fe(OH)3胶体;据(2),乙液体没有丁达尔现象,为溶液,是NaOH溶液;据(3),丙应为硅酸胶体,有关反应为H4SiO4+2NaOH=Na2SiO3+3H2O,由此丁为As2S3胶体。
本题难度:简单
4、填空题 现已确认,CO、SO2和NOx的排放是造成大气污染的重要原因。
(1)用CO2和氢气合成CH3OH具有重要意义,既可以解决环境问题,还可解决能源危机。已知CH3OH具有重要意义,既可以解决环境问题,还可解决能源危机。已知CH3OH、H2的燃烧热分别为—726.5kJ/mol、—285.8kJ/mol,写出工业上用CO2和H2合成CH3OH的热化学方程式:?。
(2)用铂作电极,一极通入空气,一极通入CH3OH(l),与KOH溶液可组成燃料电池,其负极反应式为?___。溶液中的阴离子向?极定向移动。
(3)如图是一个电化学装置示意图,用CH3OH—空气燃料电池作此装置的电源。
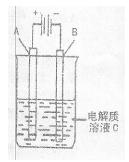
①如果A为粗铜,B为纯铜,C为CuSO4溶液。该原理的工业生产意义是?。
②如果A是铂电极,B是石墨电极,C是AgNO3溶液。通电后,
若B极增重10.8 g,该燃料电池理论上消耗____mol甲醇。(计算结果保留两位有效数字)
(4)常温下向1L、0.2 mol/L NaOH溶液中通入4.48 L(标准状况)的
SO2(忽略混合后溶液体积的变化),若测得溶液的pH<7,则溶液中c(SO32—)_?c(H2SO3)(填“>”、“<”、或“=”)。有关该溶液中离子浓度关系的判断正确的是?(填字母编号)。
A.c(S O32—)十c(OH—)+c(HSO3—)=c(Na+)+c(H+)
O32—)十c(OH—)+c(HSO3—)=c(Na+)+c(H+)
B.c(H2SO3)+c(HSO3—)+c(SO32—)=" 0.2" mol/L
C.c(H2SO3)+c(H+)=c(SO32—)十c(OH-)
D.c(Na+)>c(H+)>c(HSO3—)>c(OH—)
参考答案: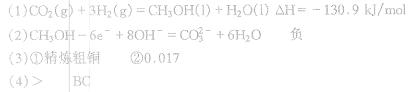
本题解析:略
本题难度:一般
5、选择题 用稀硫酸与铁片反应制取氢气时,下列措施不能使氢气生成速率增大的是
A.给反应体系适当加热
B.向反应体系中加水稀释
C.向反应体系中加入适量浓盐酸
D.将铁片换成铁粉
参考答案:B
本题解析:略
本题难度:简单