微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列事实可以用勒夏特列原理解释的是
[? ]
A.新制的氯水在光照条件下颜色变浅?
B.使用催化剂,提高合成氨的产量
C.高锰酸钾(KMnO4)溶液加水稀释后颜色变浅
D.H2、I2、HI平衡混合气体加压后颜色变深
参考答案:A
本题解析:
本题难度:一般
2、选择题 对于处于平衡状态的可逆反应mA(g)+nB(g)?pC(g)△H;升高温度或增大压强均可提高A的平衡转化率.下列说法正确的是( )
A.△H<0,m+n<p
B.△H>0,m+n>p
C.△H<0,m+n>p
D.△H>0,m+n<p
参考答案:B
本题解析:
本题难度:简单
3、选择题 在容积相同且固定不变的四个密闭容器中,进行同样的可逆反应:2A(g)+B(g)?3C(g)+2D(g),起始时四个容器所盛A、B的量分别为:甲:2mol?A,1mol?B;乙:1mol?A,1mol?B;丙:2mol?A,2mol?B;丁:1mol?A,2mol?B.在相同温度下建立平衡时,A、B的转化率大小关系正确的是( )
A.A的转化率:甲<丙<乙<丁
B.A的转化率:甲<乙<丙<丁
C.A的转化率:甲<乙=丙<丁
D.B的转化率:甲>丙>乙>丁
参考答案:A
本题解析:
本题难度:一般
4、简答题 最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇.“绿色自由”构想技术流程如下:
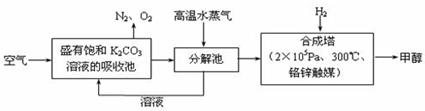
(1)在合成塔中,若有2.2kgCO2与足量H2恰好完全反应,生成气态的水和甲醇,可放出2473.5kJ的热量,试写出合成塔中发生反应的热化学方程式______.
(2)①上述合成反应具有一定的可逆性,从平衡移动原理分析,低温有利于原料气的转化,而实际生产中采用300°C的温度,其原因是______.
②“绿色自由”构想技术流程中常包括物质和能量的“循环利用”,上述流程中能体现“循环利用”的除碳酸钾溶液外,还包括______.
③下列措施中能使n(CH3OH)/n(CO2)增大的是______.
A.升高温度? ? ?B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离? ?D.再充入1molCO2和3molH2
(3)甲醇可制作燃料电池.写出以氢氧化钾为电解质的甲醇燃料电池负极反应式______.当电子转移的物质的量为______时,参加反应的氧气的体积是6.72L(标准状况下).
(4)常温下,0.1mol/L?KHCO3溶液的pH大于8,则溶液中各种离子浓度由大到小的顺序为:______.
参考答案:(1)2.2kgCO2的物质的量为:2200g44g/mol=50mol,生成1mol甲醇放出热量为:2473.5kJ50mol=49.47kJ/mol,则合成塔中发生反应的热化学方程式为:
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.47kJ?mol-1,故答案为:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.47kJ?mol-1;
(2)①实际生产中采用300°C的温度,是因为在用300°C时,催化剂活性最大,反应速率最快,故采用此温度,故答案为:考虑到催化剂的催化活性,加快反应速率;
②从反应流程来看,分解池需要高温水蒸气,而合成塔温度在300°C,故分离出甲醇后,水蒸气可循环利用,故答案为:高温水蒸气;
③使n(CH3OH)/n(CO2)增大,平衡应向正反应方向移动,升高温度,平衡逆向移动;充入氦气,反应体系浓度不变,对平衡无影响;将H2O(g)从体系中分离,减少了生成物浓度,平衡正向进行;再充入1molCO2和3molH2,相当于加压,平衡正向进行,只有CD符合,故答案为:CD;
(3)负极上燃料甲醇失电子发生氧化反应,考虑电解质的参与反应,故电极反应式为:CH3OH+8OH?-6e-═CO32-+6H2O,
n(O2)=6.72L22.4L/mol=0.3mol,1molO2反应转移4mol电子,故0.3molO2转移1.2mol,
故答案为:CH3OH+8OH?-6e-═CO32-+6H2O;1.2mol;
(4)由于碳酸氢根水解,所以c(K+)>c(HCO3-),由于水解是微弱的,所以c(HCO3-)>c(OH-),溶液显碱性,所以c(OH-)>c(H+),
氢离子来源于两个方面,一是水的电离,二是碳酸氢根的电离,故c(H+)>c(CO32-),由此可知离子浓度大小关系为:
c(K+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-),
故答案为:c(K+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-).
本题解析:
本题难度:一般
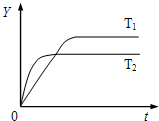
5、选择题 已知反应N2(g)+3H2(g)?2NH3(g);△H<0,向某体积恒定的密闭容器中按体积比1:3充入N2和H2,在一定条件下发生反应.如图是某物理量(Y)随时间(t)变化的示意图,Y可以是( )
A.N2的转化率
B.混合气体的密度
C.密闭容器的压强
D.H2的体积分数