微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列装置所示的实验中,能达到实验目的的是( )
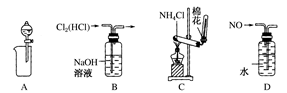
A.从Mg(OH)2悬浊液中分离出Mg(OH)2
B.除去Cl2中的HCl
C.实验室制氨气
D.排水法收集NO
参考答案:D
本题解析:A项:球型漏斗没有过滤功能,故错;B项:HCl也可以与NaOH溶液反应,故错;C项:加热NH4Cl生成氨气和氯化氢气体,故错。故选D。
点评:本题是有关实验方案的设计和评价的考查,要求学生熟悉所实验的内容及原理,能够考查同学们进行分析问题、解决问题的能力。
本题难度:一般
2、选择题 下列四组溶液,其中可用稀硫酸进行鉴别的一组是
A.BaCl2溶液、Ba(NO3)2溶液、Na2CO3溶液
B.NaCl溶液、Ba(NO3)2溶液、Na2CO3溶液
C.KCl溶液、 Ba(NO3)2溶液、MgCl2溶液
D.NaCl溶液、K2CO3溶液、Na2CO3溶液
参考答案:B
本题解析:A选项,硫酸可以和碳酸钠反应产生气体,先检验出碳酸钠,但是无法鉴别氯化钡和硝酸钡,故A错误;B选项,硫酸可以和硝酸钡反应生成白色沉淀,和碳酸钠反应产生二氧化碳气体,和氯化钠不反应,现象各不一样,可以用硫酸来检验,故B正确;C选项,硫酸和硝酸钡反应生成白色沉淀,但是无法鉴别氯化钾、氯化镁,故C错误;D选项,硫酸可以和K2CO3溶液、Na2CO3溶液反应,均会产生二氧化碳气体,无法鉴别K2CO3溶液、Na2CO3溶液,故D错误。
本题难度:一般
3、实验题 (10分)

 已知某白色混合物粉末中含有 Al2 (SO4)3、Na2SO4、NH4HCO3、NH4Cl、KCl五种物质中的两种。请完成下述探究混合物组成的实验
已知某白色混合物粉末中含有 Al2 (SO4)3、Na2SO4、NH4HCO3、NH4Cl、KCl五种物质中的两种。请完成下述探究混合物组成的实验
 限选仪器、用品与试剂:烧杯、试管、玻璃棒、胶头滴管、药匙、酒精灯、火柴、试管夹;紫色石蕊试纸;1mol·L-1硝酸、1mol·L-1盐酸、1mol·L-1NaOH溶液、Ba(NO3)2溶液、AgNO3溶液、蒸馏水。
限选仪器、用品与试剂:烧杯、试管、玻璃棒、胶头滴管、药匙、酒精灯、火柴、试管夹;紫色石蕊试纸;1mol·L-1硝酸、1mol·L-1盐酸、1mol·L-1NaOH溶液、Ba(NO3)2溶液、AgNO3溶液、蒸馏水。
 Ⅰ、初步探究
Ⅰ、初步探究
 取适量混合物于烧杯中,用蒸馏水完全溶解,得到无色透明溶液A;取少量A于试管众,滴加稀硝酸,有无色气泡产生,继续滴加稀硝酸至溶液中不再产生气泡,得到无色透明溶液B。
取适量混合物于烧杯中,用蒸馏水完全溶解,得到无色透明溶液A;取少量A于试管众,滴加稀硝酸,有无色气泡产生,继续滴加稀硝酸至溶液中不再产生气泡,得到无色透明溶液B。
 (1)上述实验证明:该混合物中肯定含有?(名称),肯定不含有?
(1)上述实验证明:该混合物中肯定含有?(名称),肯定不含有? ?(化学式)
?(化学式)
 Ⅱ、进一步探究
Ⅱ、进一步探究
 (2)为了进一步确定该混合固体的组成,需要进行实验1或实验1、2,完成下表:
(2)为了进一步确定该混合固体的组成,需要进行实验1或实验1、2,完成下表:
实验操作
| 预期现象和结论
|
实验1:取少量溶液B于试管中,加入少量 Ba(NO3)2溶液,振荡,静置观察。
| ?
|
实验2:

| ?
参考答案:(1)该混合物中肯定含有碳酸氢铵(2分),肯定不含有Al2(SO4)3(2分)
(2)
实验操作
预期现象和结论
?
如果产生白色沉淀,说明原固体混合物中含有Na2SO4,该混合物的组成为NH4HCO3和Na2SO4(1分);
如果没有白色沉淀产生,说明原固体混合物中不含Na2SO4,含有KCl或NH4Cl(1分)。
若固体混合物不含Na2SO4,取少量原固体混合物于试管,(1分)将试管套入试管夹,用火柴点燃酒精灯,充分加热。(1分)
如果试管底部有固体残留,说明混合物中含有KCl;该混合物的组成为NH4HCO3和KCl(1分);如果试管底部无固体残留,说明混合物中含有NH4Cl;该混合物的组成为NH4HCO3和NH4Cl。(1分)
本题解析:略
本题难度:简单
4、选择题 下列实验操作、现象及得出结论中,正确的是( )
A.向某无色溶液加入氢氧化钠溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体,可得出结论:溶液中含NH4+
B.用pH试纸测定某溶液的pH时,需将pH试纸放入溶液中,观察其颜色变化,跟标准比色卡比较
C.向某无色试液加入Na2CO3溶液产生白色沉淀,可得出结论:试液中含Ca(OH)2
D.向某无色溶液加入硝酸银溶液有白色沉淀产生,该溶液中一定有含Cl—
参考答案:A
本题解析:A:NH4+的检测
B:用pH试纸测定某溶液的pH时,用玻璃棒蘸取少量溶液在pH试纸上。观察其颜色变化,跟标准比色卡比较
C:能与碳酸根反应生成白色沉淀的还有Ba2+
D:加入硝酸酸化,再滴加硝酸银溶液,若出现白色沉淀不溶于硝酸,说明溶液中有氯离子,AgCl 是不溶于硝酸的白色沉淀,其他的含银不溶物可以溶解在硝酸中。
点评:在混合物中检测离子的存在或者某一物质的存在时,要充分考虑钙离子或者该物质的特性。以此作出判断。
本题难度:一般
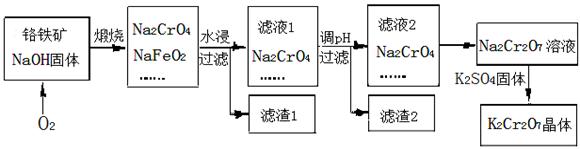
5、填空题 重铬酸钾(K2Cr2O7)为用途极广的铬化合物。铬铁矿的主要成分可表示为FeO?Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备K2Cr2O7晶体的过程
如下图所示:
已知:①K2Cr2O7有强氧化性
②NaFeO2遇水强烈水解
③Cr2O72-+ H2O 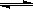 2CrO42- + 2H+ 2CrO42- + 2H+
请回答:
(1)煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是 ?。
(2)滤液1的成分除NaOH、Na2CrO4外,还含有(填化学式) ?;
生成滤渣1中红褐色物质的反应离子方程式是 ?。
(3)由滤液2转化为Na2Cr2O7溶液应加入的试剂是 。
(4)向Na2Cr2O7溶液中加入K2SO4固体,发生复分解反应而制得K2Cr2O7。生成K2Cr2O7晶体的过程是:加热浓缩、降温结晶、过滤、洗涤、干燥。试简述此法能够制得K2Cr2O7晶体的原因是:?;
洗涤时应选用 ?(选填字母)。
A.蒸馏水
B.酒精
C.稀硫酸
D.饱和K2SO4溶液
|
(5 )工业上常用Fe2+处理酸性K2Cr2O7废水,先将Cr2O72— 转化为Cr3+,该反应的离子方程式为?,再调节溶液的pH使金属离子生成沉淀而除去。
参考答案:(1)4FeO?Cr2O3 + 7O2 + 20NaOH 8Na2CrO4 + 4NaFeO2— + 10H2O(2分)
8Na2CrO4 + 4NaFeO2— + 10H2O(2分)
(2)NaAlO2、Na2SiO3(2分);? FeO2— + 2H2O=OH —+ Fe(OH)3↓(2分)?
(3)(稀)硫酸(1分)
(4)同温下K2Cr2O7晶体的溶解度小于Na2Cr2O7,冷却时会结晶析出(2分);?A(1分)
(5)6Fe2+ + Cr2O72— + 14H+ = 6Fe3+ + 2Cr3+ + 7H2O(2分)
本题解析:(2)由题目信息可知,铬铁矿的主要成分FeO?Cr2O3,含有SiO2、Al2O3等杂质,SiO2与NaOH发生反应生成Na2SiO3,Al2O3与NaOH发生反应,生成NaAlO2,故还含有Na2SiO3、NaAlO2。滤渣1中红褐色物质是由于NaFeO2水解生成氢氧化钠与氢氧化铁,反应方程式为NaFeO2+2H2O═NaOH+Fe(OH)3,
(3)由工艺流程可知,Na2CrO4在酸性条件下转化为Na2Cr2O7,故需加入的物质为稀硫酸。
(4)Na2Cr2O7溶液中加入K2SO4固体能够发生复分解反应,说明同温下K2Cr2O7晶体的溶解度小于Na2Cr2O7,便于结晶析出晶体。
本题难度:一般