微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 既可以用来鉴别乙烷和乙烯,又可以除去乙烷中混有的乙烯的方法是
A.通入足量溴水中
B.在空气中燃烧
C.通入酸性高锰酸钾溶液中
D.与足量氢气加成
参考答案:A
本题解析:乙烯中含有碳碳双键,能和溴水发生加成反应,也能被酸性高锰酸钾溶液氧化,而乙烷不能,据此可以鉴别二者。由于乙烯的氧化产物是CO2,所以不能用酸性高锰酸钾溶液除去乙烯,要用溴水来除去乙烷中的乙烯,所以答案选A。
本题难度:简单
2、选择题 NA代表阿伏加德罗常数的值,下列说法正确的是
A.将某10%的NaOH溶液加热蒸发100g水后得到20%的NaOH不饱和溶液,溶液中的Na+数目为0.05NA个
B.CO2通过Na2O2使其增重bg时,反应中转移的电子数为个
C.500mL0.5mol?L-1的NaAlO2溶液中AlO2-离子的数目为0.25NA个
D.在ag化合物CnH2n+2中共用电子对数目为个
参考答案:D
本题解析:分析:A、先根据溶质的质量守恒计算溶液的质量,再根据已知条件求出溶质的质量,根据N=nNA 计算钠离子数.
B、根据增重值与转移电子之间的关系式计算.
C、偏铝酸钠是强碱弱酸盐能水解.
D、每个CnH2n+2中共用电子对数目为3n+1,再根据N=(3n+1)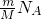 计算.
计算.
解答:A、设溶液的质量为xg,根据溶质的质量守恒,得10%x=(x-100)20%,所以x=2 00,溶质的质量为200×10%=20g,
N(Na+)=n(Na+)NA=n(NaOH)NA= NA=0.5NA,故A错误.
NA=0.5NA,故A错误.
B、2CO2+2Na2O2=2Na2CO3+O2 ,△m为2Na2CO3-2Na2O2=2CO,转移电子为2,
设转移电子x个,转移电子与增加的质量关系为
2CO2+2Na2O2=2Na2CO3+O2 ,△m? 转移电子
? 56g?2?NA
? bg? x
x=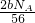
故B错误.
C、偏铝酸钠是强碱弱酸盐能水解,所以AlO2-离子的数目小于0.25NA个,故C错误.
D、每个CnH2n+2中共用电子对数目为3n+1,共用电子对数=(3n+1)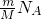 =(3n+1)
=(3n+1)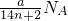 个,故D正确.
个,故D正确.
故选D.
点评:本题考查了阿伏加德罗常数的有关计算,难度不大,注意化合物CnH2n+2中每个分子的共用电子对数的计算.
本题难度:困难
3、选择题 明矾净水的作用是( )
A.除去水中氯离子
B.除去水中钙离子
C.除去水中悬浮
D.消毒杀菌
参考答案:明矾净水原理是硫酸铝钾溶液中含有铝离子,铝离子水解Al3++3H2O?Al(OH)3(胶体)+3H+,生成氢氧化铝胶体和氢离子,氢氧化铝胶体具有吸附性,可除去水中悬浮物而达到净水的目的,
故选C.
本题解析:
本题难度:简单
4、选择题 设NA为阿伏加德罗常数的值,下列有关叙述正确的是
A.28g乙烯和28g丙烯中均含有6NA对共用电子对
B.在熔融状态下,lmolNaHSO4完全电离出的阳离子数目为2NA
C.7.8gNa2O2含有的阴离子数目为0.2NA
D.在1L浓度为0.1mol?L-的Na2CO3溶液中所含阴离子数为0.1NA
参考答案:A
本题解析:分析:A、分析乙烯和丙烯的组成特点,判断二者中共用电子对的关系,二者实验式相同,当两者质量相同时,含有的C、H原子数相同,因而共用电子对数当然也就相同;
B、注意区分熔融状态和溶液中NaHSO4发生不同的电离,阳离子不同,在熔融状态下形成的Na+和HSO4-;
C、注意过氧化钠的过氧键,两个氧原子共同形成一个过氧根离子O22-;
D、注意CO32-离子水解的性质,CO32-离子水解生成HCO3-离子,溶液中的CO32-离子浓度小于0.1NA.
解答:A、题中的干扰是乙烯和丙烯中的键数不等,但实质上二者实验式相同,当两者质量相同时,含有的C、H原子数相同,因而共用电子对数当然也就相同,故A正确;
B、熔化状态下能电离的只能是原有的离子键,所以形成的是Na+、HSO4-,即阳离子为NA,故B错误;
C、氧原子个数起干扰作用,实质上两个氧原子共同形成一个过氧根离子O22-,即为0.1 NA,故C错误;
D、Na2CO3为强碱弱酸盐,在溶液中,由于CO32-离子水解生成HCO3-离子,则溶液中的CO32-离子浓度小于0.1NA,故D错误.
故选A.
点评:本题考查阿佛加德罗常数的有关知识,做题时注意分析物质存在的条件、聚集状态、物质的结构特点以及物质的性质等问题.
本题难度:简单
5、实验题 有一包白色固体粉末,可能由硫酸钠、硝酸钾、硝酸铵、碳酸钙、氯化钡、硫酸铜中的一种或几种组成,做实验得以下结果:
⑴将此固体粉末加到水中,得到白色沉淀和上层无色清液;
⑵过滤后,在滤出的白色沉淀里加入稀硝酸,白色沉淀部分溶解并有无色气体生成,该气体能使澄清石灰水变浑浊;
⑶在滤液中,加入适量的氢氧化钠溶液并加热,生成有刺激性气味的无色气体,该气体能使湿润的红色石蕊试纸变蓝。
由此实验推断:该粉末中一定含有_________________________________________;
一定不含有_______________________;可能含有____________________。(填化学式)
参考答案:一定含有:Na2SO4,BaCl2,CaCO3,NH4NO3;一定不含有:CuSO4;可能含有:KNO3。
本题解析:由题意知溶液无色。则推知不含CuSO4溶液,有白色沉淀产生,可以推知有本身不溶于水的CaCO3存在或能相互反应生成BaSO4的Na2SO4和BaCl2的存在,然后依据加入稀硝酸沉淀部分溶解,则可以推断两种沉淀均存在,又通过加入强碱产生有刺激性气味的其体可以推断含有NH4NO3,对于KNO3只能为可能含有。
本题难度:简单