微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下图表示从固体混合物中分离X的两种方案,请根据方案1和方案2指出下列说法中合理的是(?)

A.可以选用方案1分离碳酸氢钠的中含有的氯化铵
B.方案1中残留物应该具有受热易挥发的性质
C.方案2中加入的试剂一定能够与除X外的其它物质发生化学反应
D.方案2中加入NaOH溶液可以分离出SiO2和Fe2O3混合物中的Fe2O3
参考答案:D
本题解析:A、在加热的条件下,碳酸氢钠也会被分解,错误;B、方案1中残留物不具有受热易挥发的性质,而X具有受热易挥发的性质也可以达到分离的目的,错误;C、方案2中加入的试剂也可能是一种萃取剂,而不跟所有的物 质发生反应,错误;D、方案2中加入NaOH溶液可以跟二氧化硅反应,但是不能跟三氧化二铁反应,可以分离出SiO2和Fe2O3混合物中的Fe2O3,正确。
本题难度:一般
2、填空题 某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:
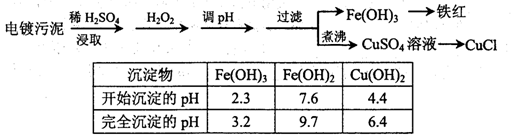
(1)酸浸后加入H2O2的目的是?。调pH步骤中加入的试剂最好是?(填化学式)。实验室进行过滤操作所用到的玻璃仪器有?。
(2)煮沸CuSO4溶液的原因是?。向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式?。
(3)CuCl产品中CuCl的质量分数大于96.50%为国家合格标准。称取所制备的CuCl样品0.2500g置于一定量的0.5mol·L-1FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol·L-1的Ce(SO4)2溶液滴定,到达终点时消耗Ce(SO4)2溶液24.60mL。有关的化学反应为:
Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+。通过计算说明该CuCl样品?(填“符合”或“不符合”)国家标准。
(4)25℃时,KSP [Fe(OH)3]= 4.0×10-38。Fe3+发生水解反应Fe3++3H2O Fe(OH)3+3H+,该反应的平衡常数为?。
Fe(OH)3+3H+,该反应的平衡常数为?。
参考答案:(14分)(1)将Fe2+氧化成Fe3+,便于调整pH值与Cu2+分离(2分);
CuO或Cu(OH)2、CuCO3等(2分);漏斗、烧杯、玻璃棒(2分)
(2)除净溶液中的H2O2,避免影响下一步CuCl的生成(2分)
2CuSO4+2NaCl+Na2SO3+H2O=2CuCl↓+2Na2SO4+H2SO4(2分)
(3)符合(2分)?(4)2.5×10-5(2分)
本题解析:(1)电镀污泥中含有铜、铁等金属化合物,酸浸后主要是溶解铜、铁等金属化合物。双氧水有强氧化性,能氧化还原性的物质,Fe2+具有还原性,酸浸后加入H2O2,Fe2+能被双氧水氧化为Fe3+,便于调整pH值与Cu2+分离;在调整pH步骤中加入的试剂是用来除去溶液中的酸,且不能引进新的杂质,所以要加入的试剂可以是CuO或Cu(OH)2或CuCO3;根据表中数据可知,当溶液的pH值4.4时,铜离子开始出现沉淀,当溶液的pH值为3.2时,三价铁离子沉淀完全,铜离子未产生沉淀,所以要使三价铁离子和铜离子分离,溶液的pH应该是3.2≤pH<4.4.生成的氢氧化铁沉淀可以通过过滤实现分离,过滤操用到的仪器有铁架台、漏斗、烧杯、玻璃棒等;其中属于玻璃仪器有漏斗、烧杯、玻璃棒。
(2)反应中过氧化氢是过量的,过氧化氢均有氧化性,如果不除去会影响CuCl的生成。双氧水受热易分解,所以煮沸CuSO4溶液的原因是除净溶液中的H2O2,避免影响下一步CuCl的生成;因为CuSO4中+2价的铜能把Na2SO3中+4价的硫氧化成+6价的硫,而+2价的铜被还原生成+1价的铜,进而生成CuCl沉淀,所以该反应的化学方程式为2CuSO4+2NaCl+Na2SO3+H2O=2CuCl↓+2Na2SO4+H2SO4。
(3)设样品中CuCl的质量为x,有关的化学反应为Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+,则由化学反应方程式可知:CuCl~~~Fe2+~~~Ce4+?
1?1
n(CuCl)?24.60×10-3L×0.1000?mol/L
解得?n(CuCl)=24.60×10-3L×0.1000?mol/L=2.46×10-3mol
所以该样品CuCl的质量为2.46×10-3mol×99.5g/mol=0.2448g
所以样品中CuCl的质量分数=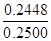 ×100%=97.91%>96.50%,所以该样品中CuCl的质量分数符合标准。
×100%=97.91%>96.50%,所以该样品中CuCl的质量分数符合标准。
(4)KSP [Fe(OH)3]=c(Fe3+)×c3(OH-)=4.0×10-38。c(H+)=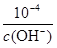 ,因此反应Fe3++3 H2O
,因此反应Fe3++3 H2O Fe(OH)3+3H+的平衡常数K=
Fe(OH)3+3H+的平衡常数K=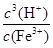 =
=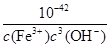 =2.5×10-5。
=2.5×10-5。
本题难度:困难
3、选择题 为达到预期的实验目的,下列方法可行的是( )
A.用溶解、过滤的方法提纯含有少量硫酸钡的碳酸钡
B.为减小中和滴定误差,锥形瓶必须洗净并烘干后才能使用
C.可用水鉴别己烷、四氯化碳、乙醇三种无色溶液
D.向混有乙酸的乙酸乙酯中加入NaOH溶液再分液,提纯乙酸乙酯
参考答案:A.硫酸钡和碳酸钡都不溶于水,直接用溶解、过滤的方法不能除去,可加入盐酸或硝酸溶解后再过滤,故A错误;
B.锥形瓶无论是否干燥,对实验结果都没有影响,故B错误;
C.己烷、四氯化碳都不溶于水,但己烷密度比水小,四氯化碳密度比水大,乙醇与水混溶,用水可鉴别,故C正确;
D.乙酸乙酯在NaOH溶液中发生水解,应用饱和碳酸钠溶液分离,故D错误.
故选C.
本题解析:
本题难度:简单
4、填空题 (15分)某种溶液仅含下表离子中的5种(不考虑水的电离与离子的水解),且各种离子的物质的量均为1mol。
阳离子
| K+、Ba2+、Fe2+、Al3+、Fe3+、Mg2+
|
阴离子
| OH—、HCO3—、CO32—、Cl—、NO3—、SO42—
|
若向原溶液中加入足量的盐酸,有气体生成。经分析知:反应后的溶液中的阴离子的种类没有变化。
(1)溶液中?(填“一定”、“一定不”、“可能”)含有HCO3—或CO32—,理由是??。
(2)原溶液中所含的阴离子有?,阳离子有?。(填离子的符号)
(3)向原溶液中加入足量的盐酸,生成无色气体的离子反应方程式:?;
(4)若向原溶液中加入足量的氢氧化钠溶液,充分反应后将沉淀过滤、洗涤、干燥并灼烧至恒重,则得到固体的质量为?g。
参考答案:(15分)
(1)一定不(2分)
CO32-与HCO3-均可与盐酸反应生成CO2气体,使溶液中阴离子种类有所变化(2分)
(2)Cl-、NO3-、SO42-?(3分)
Fe2+、Mg2+?(2分)
(3)3 Fe2++? NO3-+4H+=3 Fe3++NO↑+2H2O?(3分)
(4)120?(3分)
本题解析:略
本题难度:一般
5、选择题 不用其他试剂无法鉴别的一组溶液是
A.向浓度都为0.1mol?L-1Na2CO3和NaOH混合溶液中通入CO2,NaOH首先反应
B.向NH4Al(SO4)2溶液中滴加少量的NaOH溶液,NH4+首先反应
C.向浓度都为0.1mol?L-1的FeCl3和CuCl2混合溶液中加入铁粉,CuCl2首先反应
D.向0.1mol?L-1的FeCl3溶液中加入质量相同、颗粒大小相同的铁和铜,铜首先反应
参考答案:A
本题解析:分析:A、两种溶液无色,分别和二氧化碳反应后溶液也无色;
B、铵根离子、铝离子分别和氢氧化钠反应现象不同;
C、铁离子、铜离子和铁反应现象不同;
D、铁、铜和铁离子反应后溶液颜色不同.
解答:A、碳酸钠溶液和氢氧化钠溶液都是无色,分别和二氧化碳反应后的溶液也是无色,所以现象相同,不用其他试剂无法鉴别,故A选;
B、铵根离子和氢氧根离子反应生成刺激性气味的气体,铝离子和氢氧根离子反应生成白色沉淀,反应现象不同,所以不用其他试剂可以鉴别,故B不选;
C、铁和铁离子反应生成亚铁离子,铁消失,铜离子和铁发生置换反应生成铜单质,反应现象不同,所以不用其他试剂可以鉴别,故C不选;
D、铁和铁离子反应生成亚铁离子,溶液由黄色变为浅绿色,铜和铁离子反应生成亚铁离子和铜离子,溶液由黄色变为蓝色,反应现象不同,所以不用其他试剂可以鉴别,故D不选.
故选A.
点评:本题考查物质的检验、鉴别,题目难度不大,注意把握物质的性质为解答该类题目的关键.
本题难度:困难