微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 高纯氧化铁(α-Fe2O3)是现代电子工业的重要材料。实验室用硫铁矿烧渣(主要成分是Fe2O3、FeO、SiO2等)为原料制备高纯氧化铁的步骤如下
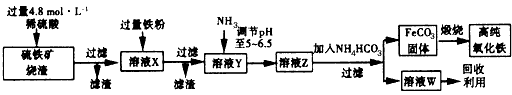
请回答下列问题:
(1)实验室用18.4 mol/L的浓硫酸配制250 mL 4.8 mol/L的硫酸溶液,所用的玻璃仪器除胶头滴管、量筒、烧杯、玻璃棒和酸式滴定管外,还需____ (填写仪器名称)。
(2)溶液X中加入铁粉后可能发生反应的离子方程式为____________________。
(3)某同学选用下列装置来制备纯净干燥的氨气,请完成下列有关问题

①装置A中可以选用下列试剂中的____(填写序 号字母);
a.(NH4)2SO4和生石灰 b.NH4Cl和Ca(OH)2固体 c.NH4HCO3固体 d.NH4Cl固体
②装置C中试剂最好选用_________(填写试剂名称);
③收集NH3时,气体应由_____(填写导管口代号)通入。
(4)写出氨水与NH4HCO3溶液反应的离子方程式_______________________
2、实验题 CuSO4·5H2O是铜的重要化合物,有着广泛的应用。以下是CuSO4·5H2O的实验室制备流程图。
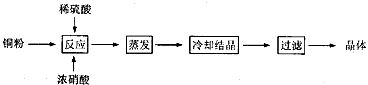
根据题意完成下列填空:
(1)向含铜粉的稀硫酸中滴加浓硝酸,在铜粉溶解时可以观察到的实验现象:______________________、________________________。
(2)如果铜粉、硫酸及硝酸都比较纯净,则制得的CuSO4·5H2O中可能存在的杂质是___________,除去这种杂质的实验操作称为____________________________。
(3)已知:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4称取0.1000 g提纯后的CuSO4·5H2O试样于锥形瓶中,加入0.1000 mol/L氢氧化钠溶液28.00 mL,反应完全后,过量的氢氧化钠用0.1000 mol/L盐酸滴定至终点,耗用盐酸20.16 mL,则0.1000 g该试样中含CuSO4·5H2O____________g。
(4)上述滴定中,滴定管在注入盐酸之前,先用蒸馏水洗净,再用___________。在滴定中,准确读数应该是滴定管上蓝线_______________________所对应的刻度。
(5)如果采用重量法测定CuSO4·5H2O的含量,完成下列步骤:①_______________②加水溶解③加氯化钡溶液,沉淀④过滤(其余步骤省略) 在过滤前,需要检验是否沉淀完全,其操作是__________________。
(6)如果1.040 g提纯后的试样中含CuSO4·5H2O的准确值为1.015 g,而实验测定结果是l.000 g 测定的相对误差为___________________。
3、实验题 某工厂有废合金(含有铝、铁、铜)粉末,甲同学探索工业废料的利用,用该废合金粉末制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,其实验方案如下
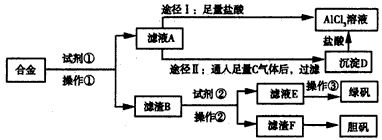
试回答下列问题:
(1)所加试剂①、②分别是___________、____________。
(2)写出废合金与试剂①反应的离子方程式:___________________。
(3)由滤液A制AlCl3溶液有途径I和途径Ⅱ两种,你认为合理的是____________,理由是_____________,写出A→D反应的离子方程式:________________。
(4)操作③的名称是______________。
4、实验题 高铁酸钾是一种重要的绿色净水剂,具有净水和消毒双重功能。某课外学习小组设计如下方案制备高铁酸钾:
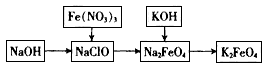
(1)①在次氯酸钠溶液中加入固体烧碱形成碱性环境。
①将研磨后的硝酸铁少量多次地加入到上述溶液中,冰浴中反应1h。该反应的离子方程式为_______________________。
②将KOH加入到反应后的溶液中搅拌半小时。静置,抽滤粗产品。该反应的化学方程式为______________________;推测该反应发生的理由是______________________。
④依次用甲苯、乙醇、乙醚洗涤以除去水分和KNO3、KCl、KOH等杂质。
(2)在强碱性溶液中,高铁酸钾能将亚铬酸盐(KCrO2)氧化为铬酸盐(K2CrO4),生成的铬酸盐溶液酸化后,得到的重铬酸钾(K2Cr2O7)用Fe(Ⅱ)的标准溶液滴定,以二苯胺磺酸钠为指示剂。到达滴定终点时,溶液由紫色变为淡绿色(+6价铬转化成+3价格)。现称取5.00g高铁酸钾样品于烧杯中,加入适量氢氧化钾溶液和稍过量的KCrO2,充分反应后,转移到250mL容量瓶中,定容。量取25.00mL溶液,用稀硫酸酸化后,用0.1000 mol·L-1的(NH4)2Fe(SO4)2标准溶液进行滴定,共用去标准溶液33.33mL。
①用离子方程式表示标准溶液显酸性的原因:____________________。
②用离子方程式表示上述滴定反应原理:______________________;如果滴定过程中,剧烈振荡,会使部分亚铁离子被空气中的氧气氧化,导致实验结果偏低。写出亚铁离子在酸性条件下被空气中氧气氧化的离子方程式:______________________。
③上述实验制得的样品中高铁酸钾的质量分数为____________________。
5、实验题 I、摩尔盐制备:将绿矾(FeSO4·7H2O)硫酸铵以相等物质的量混合可制得摩尔盐晶体。根据下图回答
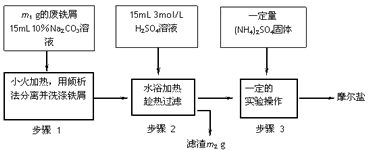
(1)步骤1中Na2CO3的主要作用是____________________。
(2)步骤3中,加入(NH4)2SO4固体后,要得到摩尔盐晶体,需经过的实验操作包括:加热蒸发、
__________、____________。
(3)步骤3中:加热是为了蒸发溶剂,浓缩结晶,应加热到___________时,停止加热。不能蒸干的原因是______________________。
II、产品中Fe2+的定量分析
将称取KMnO4固体并溶于水配成0.2mol·L-1 250mL溶液。再称取8.0g的摩尔盐样品,溶于水,并加入适量稀硫酸。用0.2mol·L-1 KMnO4溶液滴定,当溶液中Fe2+全部被氧化时,消耗KMnO4溶液体积20.00Ml。 (4)配制250mLKMnO4溶液,所需的主要仪器除玻璃棒、量筒、烧杯、胶头滴管外,还需要的玻璃仪器有
_______________ 。
(5)本实验指示剂是____________(填字母)。
A.甲基橙 B.石蕊 C.酚酞 D.不需要
(6)在滴定的过程中,要注意:
①使滴定管内的标准KMnO4溶液滴入锥形瓶中;
②_____________________________________;
③眼睛注意观察锥形瓶中溶液颜色的变化和加入KMnO4溶液的速度;
④接近终点时应该减慢加入KMnO4溶液的速度。当____________,即达到滴定终点。
(7)写出该反应中Fe2+被氧化的离子方程式_____________________________,则该产品中Fe2+的质量分数为______________。