微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 金属钛对人体体液无毒且惰性,能与肌肉和骨骼生长在一起,有“生物金属”之称。下列有关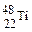 和
和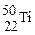 的说法中正确的是?
的说法中正确的是?
A. 和
和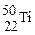 的质量数相同,互称为同位素
的质量数相同,互称为同位素
B. 和
和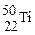 的质子数相同,互称同位素
的质子数相同,互称同位素
C. 和
和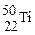 的质子数相同,是同一种核素
的质子数相同,是同一种核素
D. 与
与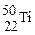 核外电子数相同,中子数不同,不能互称为同位素
核外电子数相同,中子数不同,不能互称为同位素
参考答案:
B
本题解析:
本题考查同位素。互为同位数的原子质子数相同,中子数和质量数都不同,所以A选项错误,B选项正确。核素即为一种原子, 和
和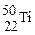 是两种不同的原子,C选项错误;核外电子数等于质子数,D选项错误。
是两种不同的原子,C选项错误;核外电子数等于质子数,D选项错误。
本题难度:一般
2、填空题 X、Y、Z、W是短周期的四种元素,有关它们的信息如下表所示。
元素
| 部分结构知识
| 部分性质
|
X
| X原子核外电子占有9个原子轨道
| X的一种氧化物是形成酸雨的主要物质
|
Y
| Y原子的次外层电子数等于最外层电子数的一半
| Y能形成多种气态氢化物
|
Z
| Z原子的最外层电子数多于4
| Z元素的最高正化合价与最低负化合价代数和等于6
|
W
| W原子的最外层电子数等于2n-3(n为原子核外电子层数)
| 化学反应中W原子易失去最外层电子形成Wn+
|
?
填写下列空白:(提示:不能用字母X、Y、Z、W作答)
(1)X有多种同素异形体,写出X2电子式是?,
(2)X、Y、Z三种元素电负性由大到小顺序为_____。
(3)W元素原子基态时原子的电子排布式_________________。
(4)Z位于元素周期表第?周期第?族
(5)含W的一种硫酸盐是常用的净水剂,常温时该溶液的pH?(填“=”、“>”或“<”),理由是:?(用离子方程式表示)。
(6).25℃、101 kPa时,32 g Y的最低价气态氢化物完全燃烧生成稳定的氧化物时放出1780.6 kJ的热量,写出该反应的热化学方程式?。
参考答案:(1)?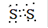 ?(2分)
?(2分)
(2)? Cl? S? C?(2分)
(3)1S22S22P63S23P1(2分)
(4)三?; ⅦA?(各1分)
(5) ﹤?(1分)? Al3++3H2O  Al(OH)3(胶体)+3H+(2分)
Al(OH)3(胶体)+3H+(2分)
CH4(g)+2O2 (g)= CO2(g)+2H2O (l) ;△H =" -890.3" KJ·mol-1(3分)
本题解析:(1)X的氧化物是形成酸雨的主要物质,结合原子核外电子排布,可知X为S,S2类似于O2,原子间有两对电子。(2)由Y原子的结构可知其为C,由Z的化合价可判断其为Cl,所以电负性:Cl>S>C。(3)由最外层电子数等于2n-3可推知,W为Al。(5)A12(SO4)3为强酸弱碱盐,水解后溶液显酸性,Al3++3H2O Al(OH)3(胶体)+3H+。(6)Y最低价即结合H最多时,该物质为CH4,32 g CH4为2 mol,所以1 mol CH4放热-890.3kJ/mol。
Al(OH)3(胶体)+3H+。(6)Y最低价即结合H最多时,该物质为CH4,32 g CH4为2 mol,所以1 mol CH4放热-890.3kJ/mol。
本题难度:一般
3、填空题 X、Y、Z、W、R是元素周期表前四周期中的常见元素,其相关信息如下表:
元素
| 相关信息
|
X
| 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2
|
Y
| 地壳中含量最高的元素
|
Z
| 存在质量数为23,中子数为11的核素
|
W
| 生活中大量使用其合金制品,工业上可用电解熔融氧化物的方法制备其单质
|
R
| 有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色
|
?
(1)W在元素周期表中的位置为?;X、Y、Z、W四种元素的原子半径从大到小的顺序是?(用元素符号表示)。
(2)X与氢两元素按原子数目比1∶3和2∶4构成分子A和B,A的结构式为?;B的电子式为?。化合物ZY中存在的化学键类型为?。
(3)砷(As)是人体必需的微量元素,与X同一主族,As原子比X原子多两个电子层,则砷的原子序数为?,其最高价氧化物对应的水化物的化学式为?。该族二、三、四周期元素的气态氢化物的稳定性从大到小的顺序是?(用化学式表示)。
(4)用RCl3溶液腐蚀铜线路板的离子方程式为?。检验溶液中R3+常用的试剂是?,可以观察到的现象是?。
(5)Z W合金(Z17W12)是一种潜在的贮氢材料,由Z、W单质在一定条件下熔炼而成。该合金在一定条件下完全吸氢的反应方程式为:Z17W12+17H2
W合金(Z17W12)是一种潜在的贮氢材料,由Z、W单质在一定条件下熔炼而成。该合金在一定条件下完全吸氢的反应方程式为:Z17W12+17H2 17ZH2+12W,得到的混合物Q(17ZH2+12W)在6.0 mol·L-1HCl溶液中能完全释放出H2。1 mol Z17W12完全吸氢后得到的混合物Q与上述盐酸完全反应,释放出H2的物质的量为?。
17ZH2+12W,得到的混合物Q(17ZH2+12W)在6.0 mol·L-1HCl溶液中能完全释放出H2。1 mol Z17W12完全吸氢后得到的混合物Q与上述盐酸完全反应,释放出H2的物质的量为?。
参考答案:(1)第三周期ⅢA族 ?Mg>Al>N>O
(2)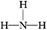 ? H∶
? H∶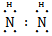 ∶H ?离子键
∶H ?离子键
(3)33 H3AsO4?NH3>PH3>AsH3
(4)2Fe3++Cu 2Fe2++Cu2+?KSCN溶液 溶液呈红色
2Fe2++Cu2+?KSCN溶液 溶液呈红色
(5)52 mol
本题解析:蛋白质主要含有C、H、O、N等元素,由化合价可知X为N;Y为O、Z为Mg、W为Al、R为Fe;(2)氮原子最外层有5个电子,每个氢原子形成3个共价键,所以N2H4的结构式为 ,然后依据结构式写出电子式;MgO属于离子化合物;(3)As位于第四周期,比上一周期同族元素的原子序数大18,由H3PO4可知As的最高价氧化物对应的水化物的化学式为H3AsO4;1 mol Mg17Al12完全吸氢后得到的混合物Q中含有17 mol MgH2、12 mol Al,与盐酸完全反应后分别生成34 mol H2、18 mol H2。
,然后依据结构式写出电子式;MgO属于离子化合物;(3)As位于第四周期,比上一周期同族元素的原子序数大18,由H3PO4可知As的最高价氧化物对应的水化物的化学式为H3AsO4;1 mol Mg17Al12完全吸氢后得到的混合物Q中含有17 mol MgH2、12 mol Al,与盐酸完全反应后分别生成34 mol H2、18 mol H2。
本题难度:一般
4、选择题 下列说法正确的是( )。
A.最外层有4个电子的原子都是非金属原子
B.非金属元素形成的单质只能与碱反应,不能与酸反应
C.金属氧化物不一定是碱性氧化物,碱性氧化物一定是金属氧化物
D.同主族金属的原子半径越大熔点越高
参考答案:C
本题解析:
考查元素周期表及周期律的知识。
A不正确,例如铅是金属;B不正确,例如碳能和硝酸反应;D不正确,例如第IA,所以答案选C。
本题难度:一般
5、填空题 (12分)A、B、C、D、E五种短周期元素,其原子序数依次增大,而原子半径按A、C、B、E、D顺序依次增大。A、D同主族;B、D、E三种元素原子的最外层电子数之和为10;E的单质可做半导体材料;C与E两元素形成的化合物可与A、C、D形成的化合物Y发生反应;B元素的气态氢化物与其最高价氧化物的水化物可以发生反应生成化合物M。1molM中含有42mol电子。回答下列问题:
(1)E元素在周期表中的位置?;化合物M中含有的化学键类型有?
(2)比较B、C、E形成的气态氢化物的稳定性由强到弱的顺序是(用化学式表示):?;写出C与A形成的18e-化合物的电子式?;
(3)用电子式表示A2C的形成过程:?
(4)写出题中生成M的化学方程式?
参考答案:(1)第三周期第ⅣA族;离子键、(极性)共价键;(2)H2O>NH3>SiH4;H2O2的电子式:
(3)H2O的形成过程: (4)NH3+HNO3=NH4NO3
(4)NH3+HNO3=NH4NO3
本题解析:根据题意可得:A是H,B是N;C是O;D是Na;E是Si。(1)Si元素核外电子排布是2、8、4,在周期表中的位置是位于第三周期第ⅣA族;化合物M是NH4NO3,是离子化合物。在阳离子和阴离子中都含有极性共价键,所以在该化合物中含有离子键和减小共价键。(2)元素的非金属性越强,其对应的氢化物的稳定性就越强,由于非金属性O>N>Si,所以O、N、Si形成的气态氢化物的稳定性由强到弱的顺序是H2O>NH3>SiH4;O与H形成的18e-化合物H2O2的电子式是 ;(3)H2O的形成过程电子式表示是:
;(3)H2O的形成过程电子式表示是: ;(4)生成M NH4NO3的化学方程式是NH3+HNO3=NH4NO3。
;(4)生成M NH4NO3的化学方程式是NH3+HNO3=NH4NO3。
本题难度:一般