微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 短周期元素的四种离子aW3+、bX+、cY2-、dZ- 它们的电子层结构相同,下列关系正确的是
A.质子数c>d
B.离子的还原性Y2->Z-
C.氢化物的稳定性H2Y>HZ
D.原子半径X<W
参考答案:B
本题解析:元素周期表前三周期元素的离子aW3+、bX+、cY2-、dZ-具有相同电子层结构,因此核外电子数相等,所以a-3=b-1=c+2=d+1。其中Y、Z为非金属,应处于第二周期,故Y为O元素,Z为F元素。W、X为金属应处于第三周期,则W为Al元素,X为Na元素。A、由以上分析可知c=8,d=9,则质子数c<d, A错误;B、非金属性F>O,非金属性越强,对应的单质的氧化性越强,则阴离子的还原性越弱,所以离子还原性Y2->Z-,故B正确;C、非金属性F>O,非金属性越强氢化物的稳定性越强,因此氢化物稳定性为HZ>H2Y,故C错误;D、W为Al元素,X为Na元素,同周期自左向右原子半径逐渐减小,则原子半径Na>Al,故D错误,答案选B。
本题难度:一般
2、选择题 右图为周期表中短周期的一部分,若a原子最外层上有5个电子,则下列说法中不正确的是
A.d单质可跟b的氢化物的水溶液反应
B.原子半径a > b > d
C.c的氢化物比a的氢化物稳定,且其还原性更弱
D.a的最高价氧化物的水化物比b的最高价氧化物的水化物酸性强
参考答案:D
本题解析:由题意,得:a为磷、b为硫、c为氯、d为氧;
2H2S+O2=2S+2H20或2H2S+3O2=2SO2+2H20,故A正确;
同周期,越往右,原子半径越小,同主族,越往下,原子半径越大,故B正确;
同周期,由左到右,原子的得电子能力逐渐增强,则气态氢化物的稳定性增强,单质的氧化性逐渐增强,则阴离子的还原性逐渐减弱,故C正确;
同周期,由左到右,原子的得电子能力逐渐增强,则最高价氧化物对应的水化物的酸性增强,则应a的最高价氧化物的水化物比b的最高价氧化物的水化物酸性弱,故D错误;
本题难度:简单
3、选择题 下列各组气体中,在通常情况下既能用浓硫酸又能用碱石灰干燥的有
A.SO2、O2、N2
B.HCl、Cl2、CO2
C.CH4、H2、CO
D.SO2、Cl2、O2
参考答案:C
本题解析:试题分析:浓硫酸具有酸性和氧化性,碱石灰具有碱性。SO2、氯化氢、氯气、CO2都不能被碱石灰干燥,所以正确的答案选C。
考点:常见常见气体干燥剂选择的有关判断
点评:该题是基础性试题的考查,属于高考中的常见考点,难度不大。该题的关键是明确各类干燥剂的性质以及气体的性质,然后灵活运用即可。
本题难度:困难
4、选择题 下列说法正确的是( )。
A.第二周期元素从C到F,非金属性逐渐减弱
B.第三周期元素从Na到Cl,原子半径逐渐增大
C.HF、HCl、HBr、HI的热稳定性依次逐渐减弱
D.LiOH、NaOH、KOH的碱性依次逐渐增强
参考答案:CD
本题解析:A中非金属性逐渐增强;B中原子半径逐渐减小;C、D两项正确。
本题难度:一般
5、选择题 对于Na+、Mg2+、Al3+三种离子,下列说法不正确的是(?)
A.核外电子层数相同
B.半径大小顺序Na+<Mg2+<Al3+
C.核外电子数相同
D.最外层电子数相同
参考答案:B
本题解析:Na+、Mg2+、Al3+三种离子的结构示意图均为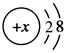 ,故A、C、D正确;对于电子层结构相同的不同离子半径比较,核电荷数越大,半径越小,故半径大小顺序应为Na+>Mg2+>Al3+,B不正确。
,故A、C、D正确;对于电子层结构相同的不同离子半径比较,核电荷数越大,半径越小,故半径大小顺序应为Na+>Mg2+>Al3+,B不正确。
本题难度:一般