微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (7分).H2SO4的摩尔质量为? ?。1.204×1024个H2SO4分子物质的量为?,其中含?molO,含H的质量为?。
?。1.204×1024个H2SO4分子物质的量为?,其中含?molO,含H的质量为?。
参考答案:98g/mol? 2mol? 8? 4g
本题解析:略
本题难度:简单
2、计算题 黄铜矿(主要成分CuFeS2)是提取铜的主要原料
已知:2CuFeS2+4O2 Cu2S+3SO2+2FeO?炉渣产物Cu2S在1200℃高温下继续反应: 2Cu2S+3O2 → 2Cu2O+2SO2, 2Cu2O+Cu2S → 6Cu+SO2,假定各步反应都完全,完成下列计算:
Cu2S+3SO2+2FeO?炉渣产物Cu2S在1200℃高温下继续反应: 2Cu2S+3O2 → 2Cu2O+2SO2, 2Cu2O+Cu2S → 6Cu+SO2,假定各步反应都完全,完成下列计算:
①由6 mol CuFeS2生成6 mol Cu,求消耗O2的物质的量 mol
②6 mol CuFeS2和14.25 mol O2反应,理论上可得到 mol铜
参考答案:15, 4.5 (每空3分)
本题解析:①由6 mol CuFeS2生成6 mol Cu,则n(Cu2O)=2mol;n(Cu2S)=1mol;根据Cu元素守恒可知需要CuFeS2的物质的量是n(CuFeS2)=6mol;6mol的CuFeS2完全氧化变为3mol的Cu2S消耗O2的物质的量是12mol;产生的3mol的Cu2S中2mol的Cu2S氧化为2mol的Cu2O消耗3mol的O2;所以由6 mol CuFeS2生成6 mol Cu,求消耗O2的物质的量是12mol+3mol=15mol;② 6 mol CuFeS2,发生第一个反应消耗12mol的O2;还有剩余的O2的物质的量是2.25 mol .根据第二个式子可知:3mol的O2会消耗2mol的Cu2S,则2.25 mol的O2会发生反应消耗Cu2S的物质的量是(2.25 mol÷3)×2="1." 5 mol。产生Cu2O1. 5 mol,还有Cu2S的物质的量是3mol—1. 5 mol ="1." 5 mol ,根据方程式2Cu2O+Cu2S = 6Cu+SO2中两种物质的物质的量关系可知Cu2S过量,产生Cu的物质的量应该1. 5 mol×3="4.5" mol。
考点:考查物质的量有过量时的计算的知识。
本题难度:一般
3、选择题 在一定体积的密闭容器中通入a mol NO和b mol O2,反应容器内氮原子个数与氧原子个数之比为()
A.a/b
B.a/(a+b)
C.a/(a+2b)
D.a/2(a+b)
参考答案:C
本题解析:由于在化学反应中,原子是不变的,所以无论怎么反应,氮原子和氧原子的物质的量分别都是amol和(a+2b)mol,即反应容器内氮原子个数与氧原子个数之比为a/(a+2b),答案选C。
点评:该题在计算时应该利用原子守恒,而不必要判断物质的过量。
本题难度:一般
4、选择题 VLFe2(SO4)3溶液中含有a克SO42—的溶液取0.5VL,用水稀释至2VL,则稀释后溶液中Fe3+的物质的量的浓度为
A.a/576V mol·L-1
B.a/125 mol·L-1
C.250a/ 36V mol·L-1
D.250a/48V mol·L-1
参考答案:A
本题解析:略
本题难度:简单
5、计算题 用0.05mol/L的Ba(OH)2溶液,滴定盐酸和硫酸的混合液,下图分别是Ba(OH)2溶液加入量和pH值,以及沉淀量的关系,求原混合液中H+、Cl-、SO42-的物质的量浓度。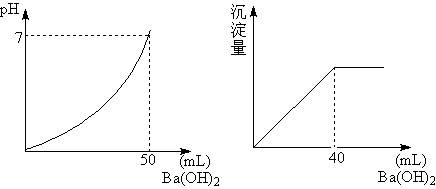
参考答案:[H+]=1mol/L,[Cl—]=0.2mol/L,[SO42-]=0.4mol/L。
本题解析:关键是看懂图象,左图为加入50mLBa(OH)2,恰好将混酸完全中和。右图是滴入Ba(OH)4 40mL,将混酸中SO42-完全沉淀,然后依据这两点的离子反应所决定的量解析。由左图看,滴入Ba(OH)2前混酸pH=0,所以[H+]=1mol/L;
由图象可知:加入50mLBa(OH)2,恰好将混酸完全中和。
设混酸体积为x,则有:1mol/L×x=0.05mol/L×2×0.05L,x=0.005L 。 由图可知,滴入Ba(OH)4 40mL,将混酸中SO42-完全沉淀:
[SO42-]= ? =0.4mol/L
=0.4mol/L
[HCl]=  =0.2mol/L
=0.2mol/L
所以原混合液[H+]、[Cl—]、[SO42-]分别为:1mol/L, 0.2mol/L, 0.4mol/L。
本题难度:简单