微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 选做题:图表示某些化工生产的流程(部分反应条件和产物略去):

(1)反应I需在500℃进行,其主要原因是______.
(2)H转化为N的过程中,需要不断补充空气,其原因是______.
(3)写出反应Ⅲ的化学方程式______.
(4)工业上,向析出K的母液中通氨气,加入细小食盐颗粒,冷却后可析出副产品.通入氨气的作用是______(填序号).
a.增大NH4+的浓度,使J更多地析出
b.使K更多地析出
c.使K转化为M,提高析出的J的纯度
(5)写出上述流程所涉及的化学工业的名称______.
参考答案:液态空气蒸馏主要得到O2和N2,焦炭和水蒸气在高温下反应生成CO和H2,二者得到的气体B、C在催化剂条件下能发生反应,则应为N2和H2的反应,生成的气体为NH3,所以,A为O2,B为N2,C为H2,D为CO,E为NH3,NH3和O2在催化剂条件下发生氧化还原反应生成NO,NO与反应生成NO2,进而与水反应生成,所以,G为NO,H为NO2,I为HNO3,L为NH4NO3,CO和O2反应生成CO2,CO2、NaCl和NH3反应生成NaHCO3,为侯氏制碱法的主要反应,NaHCO3加热分解生成Na2CO3,则F为CO2,
J为NH4Cl,K为NaHCO3,M为Na2CO3;
(1)反应I是工业合成氨气的反应,需在500~℃进行,其主要原因是此温度下催化剂活性最高;故答案为:此温度下催化剂活性最高;
(2)H转化为N的过程中是二氧化氮和水反应生成硝酸和一氧化氮的反应,反应是化学平衡,需要不断补充空气使一氧化氮气体不断转化为二氧化氮,提高原料的利用率,故答案为:使一氧化氮气体不断转化为二氧化氮,提高原料的利用率;
(3)反应Ⅲ是候氏制碱法的反应原理,氨化的饱和食盐水中通入二氧化碳生成碳酸氢钠晶体和氯化铵,反应的化学方程式为:NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl;
故答案为:NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl;
(4)工业上,向析出K的母液为氯化铵中通氨气,加入细小食盐颗粒,冷却后可析出副产品J氯化铵,通入氨气的作用是增大铵根离子浓度使氯化铵晶体析出,氨气溶于水后生成氨水,氨水电离成铵根,增大铵根的浓度有利于氯化铵的析出来分析;同时通入氨气使溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度;故答案为:ac;
(5)上述流程所涉及的化学工业的名称为:工业合成氨、氨气的催化氧化、侯德榜制碱法;故答案为:工业合成氨、氨气的催化氧化、侯德榜制碱法;
本题解析:
本题难度:一般
2、填空题 (11分)盐A(含结晶水)可发生如下的转化关系(部分生成物略去)。其中B、D、E为无色气体,C为白色沉淀,H为红褐色沉淀。在混合液X中加入BaCl2可生成不溶于稀HNO3的白色沉淀。
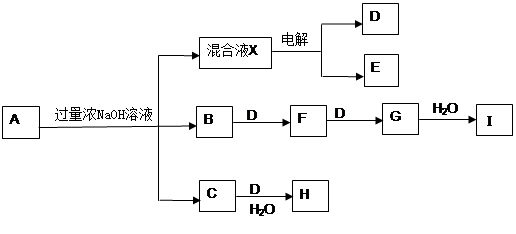
(1)写出由B→I的工业意义_______________________
(2)写出下列反应的化学方程式
G→I?
C→H?
(3)电解混合液X的阳极电极反应式为?
(4)若盐A 1.960g和过量浓NaOH溶液加热充分反应,收集到B 224ml(标准状况),将H洗涤、烘干、灼烧、称量得0.400g,向混合液中加入盐酸酸化,再加入足量的BaCl2溶液,将沉淀过滤、洗涤、烘干、称量得2.33g,则A的化学式为___________________。
参考答案:(1)工业制取硝酸?(2分)
(2)3NO2 +H2O="===" NO+2HNO3?(2分) 4Fe(OH)2+ O2 + 2H2O =" 4" Fe(OH)3?(2分)
(3)4OH- - 4e- = O2↑+ 2H2O?(2分)?(4)(NH4)2Fe(SO4)2 ? 6H2O?(3分)
本题解析:H为红褐色沉淀则为氢氧化铁,可推出C为氢氧化亚铁D为氧气, 混合液X中加入BaCl2可生成不溶于稀HNO3的白色沉淀。可推出中X含有硫酸根离子,再根据B→I的反应排除硫循环,只剩下熟悉的氮循环,则可推出B为氨气F为一氧化氮G为二氧化氮I为硝酸。
(1)根据B→I的反应可知其为工业制取硝酸。
(2)二氧化氮溶于水生成了一氧化氮和硝酸,氢氧化亚铁被空气氧化成氢氧化铁。
(3)X含有硫酸根离子和氢氧根离子,阴离子在阳极失去电子,根据电离顺序可知氢氧根离子失去电子。
(4)根据质量守恒原理和元素守恒原理,可计算出铵根离子、硫酸根离子、铁离子的质量,再根据质量守恒原理可计算出结晶水的质量,进而可推出相应的化学式。
点评:本题考查常见的铁、氮化合物之间的转化及其性质,以H为红褐色沉淀为突破点,学生需要掌握常见化合物的颜色以及其他特殊性质。
本题难度:一般
3、填空题 (8分)如图所示,已知A、D、E、F是中学常见的单质,B、C是氧化物,且B是红棕色固体,请填空:
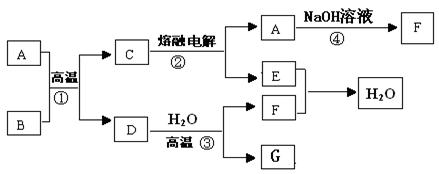
(1)A 是?, B是?。(填化学式)
(2)写出反应③的化学方程式为?。
(3)写出反应④的化学方程式为?。
(4)C电解时,每生成1molA ,同时生成?molE。
参考答案:(共8分)
(1)Al (1分) Fe2O3(1分)
(2)3Fe+4H2O(g)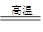 Fe3O4+4H2?(2分)
Fe3O4+4H2?(2分)
(3)2Al+2NaOH +2H2O= 2NaAlO2+3H2↑(2分)
(4)0.75(2分)
本题解析:由所给物质的类型及颜色状态,可知AB发生了铝热反应,即:2Al + Fe2O3 ?Al2O3 + 2Fe。反应②2Al2O3
?Al2O3 + 2Fe。反应②2Al2O3 4Al+3O2↑,反应③3Fe+4H2O(g)
4Al+3O2↑,反应③3Fe+4H2O(g) Fe3O4+4H2;
Fe3O4+4H2;
本题难度:一般
4、填空题 一种白色晶体A极易溶于水,将A配成溶液进行如下框图所示的实验,实验现象及转化关系如下列框图所示。
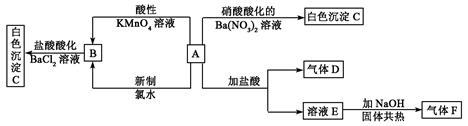
其中A为正盐,气体D能使品红溶液褪色,气体F能使湿润的红色石蕊试纸变蓝。试回答下列问题:
(1) 写出下列物质化学式:A:_________________;C:_________________;
写出下列物质化学式:A:_________________;C:_________________;
(2)写出E的电子式_____________;F的结构式__________________
(3)写出下列反应的 离子方程式:
离子方程式:
①由B生成C:________________________________________________________
②A和新制氯水反应:___________________________________________________。
参考答案:(每空2分,共12分)
(1)(NH4)2SO3 ?BaSO4
(2)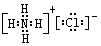 ?
?
(3)Ba2++ SO42—= BaSO4↓? SO32—+Cl2+H2O = SO42—+2H++2Cl—
本题解析:略
本题难度:简单
5、推断题 下列是中学化学中常见物质间的反应转化关系图,其中部分产物已略去。已知:A、D是单质,且C、E、G中均含有A单质中的元素,B、F、H中均含有D单质中的元素;常温下,除C、E外其他物质均为固体。
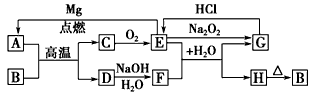
试回答下列问题:
(1)写出下列物质的化学式:A________,H________。
(2)写出下列变化的化学方程式:
E→G_____________________, D→F____________________, E→A_____________________。
(3)B的用途(至少说出一种)_____________________。
参考答案:(1)C;H2SiO3
(2)2Na2O2+2CO2==2Na2CO3+O2;Si+2NaOH+H2O==Na2SiO3+2H2↑;2Mg+CO2 C+2MgO
C+2MgO
(3)制造光导纤维
本题解析:
本题难度:一般