微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
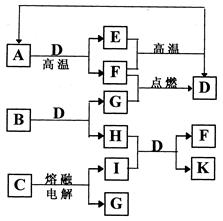
1、实验题 (13分)已知X为中学化学中一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的氧化物可作耐火材料,可用它来制造耐火坩埚和耐高温试验仪器;H为气体单质,D为无色气体,D在空气中会出现红棕色。各物质的转化关系如下图(部分反应物已略去)。
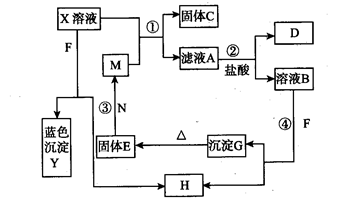
请回答下列问题:
(1)E的化学式为_______________(2分)。
(2)将M丝插入盛有X溶液的试管中,反应一段时间后的现象是_______________(2分)。
(3)在反应①②③④中属于置换反应的是__________(填序号)(2分)。
(4)反应②的离子方程式为______________________________________________(2分)。
(5)用石墨作电极电解50mL X溶液,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;电解一段时间后,取出A电极,洗涤、干燥、称量,电极增重1.6g。请回答下列问题:
①写出电解时的阳极反应式________________________________________(2分)。
②电解后溶液的pH为_______________________________(3分)(假设电解前后溶液体积不变)。
参考答案:(1)Fe2O3(2分)? (2)铁丝上附有红色物质,溶液颜色变浅(2分)
(3)(1)(3)(2分)? (4)2Fe2++NO3-+4H+=3Fe3++NO↑+2H2O(2分)
(5)①4OH--4e-=O2+2H2O(2分)?②0(3分)
本题解析:F为淡黄色固体,可能为硫或Na2O2,它可与溶液B或溶液X均产生无色气体H及沉淀Y(蓝色沉淀必定为Cu(OH)2)或G,可判定F为Na2O2,H为氧气,X为铜盐;
由“N的氧化物可作耐火材料,可用它来制造耐火坩埚和耐高温试验仪器”知道N必为铝,不溶于水的氢氧化物G加热脱水生成氧化物E,E与铝可生成另一常见金属M,可知这属于铝热反应,铝与氧化物E:Fe2O3置换出M:铁单质:③2Al+Fe2O3 Al2O3+2Fe
Al2O3+2Fe
铁与铜盐M发生置换出C:铜和滤液A:亚铁盐溶液,加入盐酸后生成NO(D为无色气体,D在空气中会出现红棕色,说明D一定为NO,在空气中被氧化为红棕色的NO2),说明A必定为硝酸盐:②2Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,从而可知X为硝酸铜,A为硝酸亚铁,B为硝酸铁溶液;
(1)Fe2O3
(2)铁与硝酸铜发生置换反应:①Fe+CuSO4=FeSO4+Cu,故铁丝上附有红色物质,溶液颜色由蓝色转变了浅绿色
(3)反应④:2Na2O2+2H2O=4NaOH+O2↑? FeCl3+3NaOH=Fe(OH)3↓+3NaCl,①②③④属于置换反应的是①③
(4)2Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
(5)总电解反应式为:2Cu(NO3)2+2H2O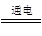 2Cu+O2↑+4HNO3
2Cu+O2↑+4HNO3
①阳极上有氧气生成:4OH--4e-=O2↑+2H2O
②由总反应式可知,铜为1.6g,同时得到n(HNO3)=0.05mol,c(HNO3)=0.05mol/0.05L=1mol/L
c(H+)=1mol/L,pH=0
本题难度:一般
2、填空题 (16分)有A、B、C三种短周期元素在周期表中相对位置如下图:
(1)A与C形成的液态化合物是常见的重要有机溶剂,则A、B、C三种元素最高价氧化物对应的水化物酸性由强到弱的顺序是:?>?>??(用化学式表示)。
(2)X、Y为B、C两种元素形成的单质。标准状况下,X的密度为3.17g/L。Z是一种化合物,焰色反应呈紫色(透过钴玻璃),室温下0.1mol/LZ水溶液pH=13。X、Y、Z有如图转化关系:
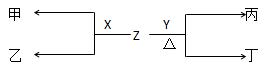
①写出X与Z反应的离子 方程式:?。
方程式:?。
②已知丙能与稀硫酸反应生成使品红褪色的气体。丁的电子式?,丁的水溶液pH?7(填“大于”“小于”或“等于”),其原因为
?(用离子方程式表示)。
③将20mL0.5mol/L丙溶液逐滴加入20mL0.2mol/LKMnO4溶液(硫酸酸化)中,恰好褪色。写出反应的离子方程式?。
④写出X与水反应生成两种酸的电子式?,?。
参考答案:
本题解析:略
本题难度:一般
3、简答题 某强酸性溶液X,含Ag+、Al3+、SiO2-3、NH+4、Fe2+、Fe3+、CO2-3、Cl-、NO-3中的一种或几种离子,取X溶液进行连续实验,能实现如下转化:

依据以上信息,回答下列问题:
(1)上述离子中,溶液x中肯定含有的是:______;不能肯定的是:______;对不能确定是否存在的离子,可以另取x溶液于一支试管中,选择下列试剂中的某一种加入X溶液,根据现象就可判断,则试剂可以选(若多种选法中间加“或“字间隔):______.
①酚酞试剂,②石蕊试剂,③pH试纸,④KSCN溶液,⑤KMnO4溶液,⑥苯酚溶液
(2)气体G的化学式为:______;沉淀E的化学式为:______;沉淀J的化学式为:______.
(3)实验中,产生的气体A为无色,但如果暴露在空气中可以观察到的现象是:______;写出步骤①中生成气体A的离子方程式______.
(4)要使步骤②中,A、H2O、O2三种物质恰好发生化合反应,则A、H2O、O2物质的量之比是:______.
参考答案:在强酸性溶液中一定不会存在CO32-和SiO32-离子,加入过量硝酸银生成沉淀,则该沉淀为氯化银沉淀,说明溶液中含有氯离子,生成气体A,A可以和氧气水反应生成溶液D,依据离子分析只有Fe2+在酸性溶液中加入硝酸银后会形成稀硝酸氧化亚铁离子为三价铁离子,本身被还原为一氧化氮气体,则A为NO,D为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子,溶液B中加入过量NaOH溶液,生成气体G,则G为NH3,说明溶液中含有NH4+离子,过量氢氧化钠溶液中生成沉淀E是Fe(OH)3,溶液F中通入过量二氧化碳会生成沉淀J,则J为Al(OH)3,I为NaAlO2,说明溶液中含有Al3+离子,溶液中含有Fe2+离子,就一定不含NO3-离子,含有Cl-离子就一定不含Ag+离子,不能确定是否含有的离子Fe3+,以此解答;
(1)依据分析判断溶液x中肯定含有的是:Cl-、Al3+、Fe2+、NH4+;不能确定的是Fe3+,依据三甲胺铁离子的特征性质进行鉴别;①酚酞试剂,是酸碱指示剂,不能检验三价铁的存在;②石蕊试剂,是酸碱指示剂,不能检验三价铁的存在;③pH试纸,是测定溶液酸碱性,不能检验三价铁的存在;④KSCN溶液,与三价铁离子反应生成血红色溶液,可以检验;⑤KMnO4溶液,无变化,不能检验三价铁离子;⑥苯酚溶液和三价铁离子形成紫色溶液,可以检验;
故答案为:Cl-、Al3+、Fe2+、NH4+;Fe3+;④⑥;
(2)依据上述分析判断,气体G的化学式为:NH3;沉淀E为的化学式为:Fe(OH)3;沉淀J的化学式为:Al(OH)3;故答案为:NH3;Fe(OH)3;Al(OH)3;
(3)实验中,产生的气体A为无色的一氧化氮气体,但如果暴露在空气中可以观察到的现象是从无色变化为红棕色,步骤①中生成气体A为NO,反应是亚铁离子被酸性溶液中的硝酸根离子氧化为三价铁离子,反应的离子方程式为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
故答案为:无色变化为红棕色;3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
(4)要使步骤②中,NO、H2O、O2三种物质恰好发生化合反应生成硝酸,发生的反应是4NO+3O2+2H2O=4HNO3;则A(NO)、H2O、O2物质的量之比是:4:3:2;
故答案为:4:3:2;
本题解析:
本题难度:一般
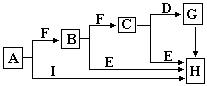
4、填空题 (15分)下图是某些常见物质之间的转化关系。A、I是金属单质,F、G是非金属单质。已知B的相对分子质量在75~80之间,E是A的氧化物、其相对分子质量为232。请按要求填写下列空白:
(1)A、B、C代表的物质分别是?,?,?(填化学式)。
(2)写出B物质的电子式?。
(3)K的水溶液呈碱性,用离子方程式说明其呈碱性的原因?。
(4)写出I→K的离子方程式:?。
(5)当有0.15molA完全反应时,反应中转移电子的物质的量为?。
参考答案:
(1)Fe,? Na2O2,? Al2O3。?(每空2分,共6分)
(2)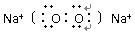 (2分)
(2分)
(3) AlO2— + 2 H2O Al(OH)3 + OH—?(2分,没配平只给1分)
Al(OH)3 + OH—?(2分,没配平只给1分)
(4)2Al + 2OH— + 2H2O = 2AlO2— + 3H2↑(2分,没配平只给1分)
(5)0.4 mol(3分。无单位扣1分)
本题解析:略
本题难度:一般
5、填空题 下面是有关物质的转化关系图(有些物质己省略),其中A为单质,E在常温下为液体,D是一种含氧的化合物,请回答相关问题。
(1)若C的式量为78,则对C的结构、性质推断中不正确的是_____
A.久置于空气中会变成白色?
B.具有强的氧化性
C.晶体存在离子键与非极性键?
D.与湿润的紫色石蕊试纸接触时,只能使试纸变蓝色
(2)A的原子结构简图______________,H的电子式___________,E的结构式_________
(3)若C也是含氧化合物且氧为18O时,写出C与D反应的方程式___________________
_______________,另一产物(D以外)的摩尔质量为______。
(4)当A量较少时,I不可能是____________
A.H2O? B.NaCl(aq)? C.NaOH(aq)? D.CuCl2
(5)若没有E在常温下为无色液体的限制,则E、I还可分别是_________、_________(填物质名称)
参考答案:(1) D(2分) (2) 、
、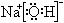 H-O-H或
H-O-H或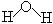 (3分)
(3分)
(3)2Na218O2+2CO2=2Na2CO2·18O+18O2、36g/mol,(3分)
(4)D (2分)? (5)盐酸或SO3、氯气或硫酸(2分)
本题解析:单质A能与同一物质F连续发生两次反应,这样的单质常见的有C、S、N2(此时F为O2)或A为P而F为Cl2,结合C的式量值可初步确定A为钠、C为Na2O2、B为Na2O、D为CO2、G为Na2CO3、H是NaOH,此时I不可能是CuCl2。Na2O2在空气中会与CO2反应最终转化为Na2CO3白色固体,晶体中存在钠氧离子键与“O-O”共价键,其中的氧元素为-1价,具有强的氧化性,能漂白包括酸碱指示剂在内的许多有色物质;也能表现出一定的还原性;与水或CO2反应是一个自身氧化还原反应。当E为盐酸或SO3、I为氯气或硫酸时也能实现上述变化。
本题难度:简单