微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用水稀释0.5mol·L-1的醋酸(CH3COOH)溶液,其中随水量的增加而增大的是
[? ]
①H+的物质的量 ②c(H+) ③c(H+)/c(CH3COOH) ④c(CH3COOH)/c(CH3COO-) ⑤c(OH-)
A、①③⑤
B、①④⑤
C、②④
D、③④
参考答案:A
本题解析:
本题难度:一般
2、选择题 下列叙述不正确的是
A.在稀盐酸中 c(H+)=c(Cl—)+c(OH—)
B.常温下,在0.1mol/L的HNO3溶液中由水电离出的c(H+)<
C.将Na2CO3水溶液加热、蒸干,最后得到NaOH固体
D.酸与碱完全中和,所得溶液的pH可能大于7
参考答案:C
本题解析:A、根据电荷守恒,稀盐酸中c(H+)=c(Cl—)+c(OH—)成立,正确;B、硝酸的存在对水的电离起抑制作用,所以水电离出的c(H+)<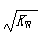 ,正确;C、盐的水解是吸热反应,加热促进水解,但第二步
,正确;C、盐的水解是吸热反应,加热促进水解,但第二步
水解非常微弱,所以不会有二氧化碳气体放出,平衡不会一直正向移动,因此最终得到的仍是碳酸钠固体,错误;D、酸与碱完全中和,所得溶液的pH大于7、小于7、等于7都有可能,依据酸、碱的强弱决定,正确,答案选C。
本题难度:一般
3、选择题 在25℃时,甲、乙两个烧杯中分别盛有1 L、pH均为2的盐酸和醋酸,现分别投入0.12 g镁粉充分反应,下列说法中,正确的是
A.反应过程中,两个烧杯中产生氢气的速率一直相等
B.反应结束后,两个烧杯中产生氢气的物质的量相等
C.反应结束后,乙烧杯中有镁粉剩余
D.反应结束后,甲烧杯中溶液呈中性
参考答案:B
本题解析:盐酸是强酸,则pH=2的盐酸溶液的浓度是0.01mol/L,因此溶液中氢离子的物质的量是0.01mol。醋酸是弱酸,存在电离平衡CH3COOH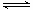 CH3COO-+H+,所以pH=2的醋酸溶液的浓度大于0.01mol/L。金属镁的物质的量是0.12g÷24g/mol=0.005mol,所以镁与盐酸反应时二者恰好反应,与醋酸反应时镁是不足的。A、醋酸是弱酸,在反应过程中不断电离出氢离子,因此反应过程中,两个烧杯中产生氢气的速率是醋酸的大于盐酸的,A不正确;B、反应结束后,两个烧杯中产生氢气的物质的量相等,都是0.005ml,B正确;C、反应结束后,甲烧杯中有镁粉剩余,C不正确;D、反应结束后,甲烧杯中生成的氯化镁水解,溶液显酸性,D不正确,答案选B。
CH3COO-+H+,所以pH=2的醋酸溶液的浓度大于0.01mol/L。金属镁的物质的量是0.12g÷24g/mol=0.005mol,所以镁与盐酸反应时二者恰好反应,与醋酸反应时镁是不足的。A、醋酸是弱酸,在反应过程中不断电离出氢离子,因此反应过程中,两个烧杯中产生氢气的速率是醋酸的大于盐酸的,A不正确;B、反应结束后,两个烧杯中产生氢气的物质的量相等,都是0.005ml,B正确;C、反应结束后,甲烧杯中有镁粉剩余,C不正确;D、反应结束后,甲烧杯中生成的氯化镁水解,溶液显酸性,D不正确,答案选B。
本题难度:一般
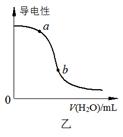
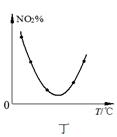
4、选择题 下列图示与对应的叙述相符的是
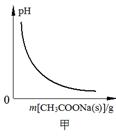
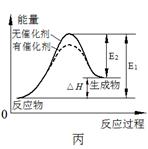
A.图甲表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化
B.图乙表示向CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b
C.图丙表示催化剂能改变化学反应的焓变
D.图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g) N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0